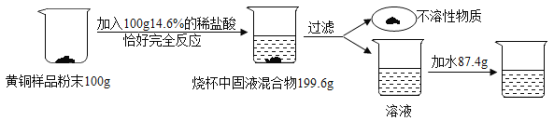
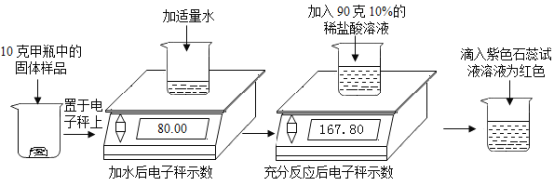
题目内容
【题目】现有![]() 的
的![]() 溶液,请按照下面要求计算:
溶液,请按照下面要求计算:
![]() 上述溶液中所含溶质的质量为______。
上述溶液中所含溶质的质量为______。
![]() 上述溶液与足量
上述溶液与足量![]() 的盐酸反应,最多可生成
的盐酸反应,最多可生成![]() 多少克______?
多少克______?
![]() 向106g上述溶液中逐滴加入
向106g上述溶液中逐滴加入![]() 的盐酸并不断搅拌,此时发生的反应为:
的盐酸并不断搅拌,此时发生的反应为:![]() ;当
;当![]() 全部转化为
全部转化为![]() 后,再加入盐酸才开始放出
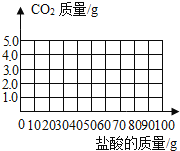
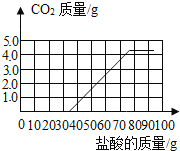
后,再加入盐酸才开始放出![]() 请在图中画出产生气体的曲线______。
请在图中画出产生气体的曲线______。
![]() 另取
另取![]() 溶液边搅拌边加入
溶液边搅拌边加入![]() 的盐酸,有关反应物与生成物的量如表格:
的盐酸,有关反应物与生成物的量如表格:
物质 |
| HCl | x | NaCl |
|
|
质量 |
|
|
|
|
| m |
则x是______;![]() ______。
______。
【答案】![]()
![]()
![]()
![]()
【解析】
(1)根据溶质质量![]() 溶液质量
溶液质量![]() 溶质质量分数,故106g溶液中所含溶质的质量
溶质质量分数,故106g溶液中所含溶质的质量![]() 。
。
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有
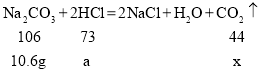
![]()
![]()
解得![]() ,
,![]()
答:最多可生成![]() 的质量为
的质量为![]() 。
。
(3)设将碳酸钠全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y
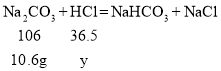
![]()
解得![]()
所以将碳酸钠全部转化为碳酸氢钠需要盐酸溶液的质量为:![]() ,
,
由第![]() 题解得的结果知,将碳酸钠全部转化为二氧化碳消耗盐酸溶液的质量为:
题解得的结果知,将碳酸钠全部转化为二氧化碳消耗盐酸溶液的质量为:![]() ,生成的CO2质量为4.4g。
,生成的CO2质量为4.4g。
故产生二氧化碳气体的曲线为:
(4)根据表格提供的数据,结合化学方程式:
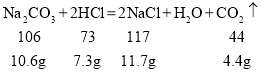
可知,生成![]() 二氧化碳,需完全反应碳酸钠的质量是
二氧化碳,需完全反应碳酸钠的质量是![]() ,生成氯化钠的质量是
,生成氯化钠的质量是![]() 。因此题目中给出的碳酸钠有一部分转化生成了碳酸氢钠和氯化钠,故x为
。因此题目中给出的碳酸钠有一部分转化生成了碳酸氢钠和氯化钠,故x为![]() 。碳酸钠和HCl是反应物,碳酸氢钠、氯化钠、二氧化碳和水是生成物,根据质量守恒定律可得
。碳酸钠和HCl是反应物,碳酸氢钠、氯化钠、二氧化碳和水是生成物,根据质量守恒定律可得![]() ,
,![]() 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】已知某盐在不同温度下的溶解度如下表所示。若把溶质质量分数为22%的该盐溶液由50℃逐渐冷却,则开始析出晶体的温度范围是_____。
温度/℃ | 0 | 10 | 20 | 30 | 40 |
溶解度/g/100g水 | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
【题目】现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为1.22g/cm3的硫酸并做相关记录。关数据记录如下表:
加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
1 | 20.0 | 16.0 |
2 | 20.0 | 12.0 |
3 | 20.0 | 8.0 |
4 | 20.0 | 8.0 |
试计算:
(1)10.0g此样品中铜的质量_____。
(2)样品中氧化亚铁的质量分数_____。
(3)所用硫酸溶液溶质的质量分数_____。