题目内容
【题目】请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:
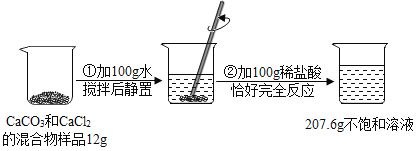
(1)计算原混合物样品中CaCl2的质量__________。
(2)计算稀盐酸中溶质质量__________。
(3)计算恰好反应后的溶液的溶质质量分数__________(结果保留至0.1%)。
【答案】2g 7.3g 6.3%
【解析】
(1)解:设原混合物中碳酸钙的质量为X。
根据质量守恒定律,生成二氧化碳气体的质量为:![]() 。
。
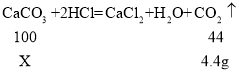
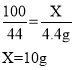
原混合物样品中CaCl2的质量为:![]() 。
。
答:原混合物样品中CaCl2的质量2g。
(2)解:设稀盐酸中氯化氢的质量为Y。
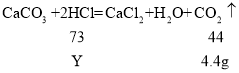
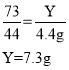
答:稀盐酸中溶质的质量为7.3g。
(3)解:设恰好反应后的溶液的溶质为M。
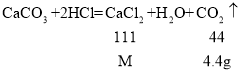
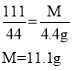
恰好反应后的溶液的溶质质量分数为![]()
答:恰好反应后的溶液的溶质质量分数为6.3%。

练习册系列答案
相关题目
【题目】已知某盐在不同温度下的溶解度如下表所示。若把溶质质量分数为22%的该盐溶液由50℃逐渐冷却,则开始析出晶体的温度范围是_____。
温度/℃ | 0 | 10 | 20 | 30 | 40 |
溶解度/g/100g水 | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
【题目】现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为1.22g/cm3的硫酸并做相关记录。关数据记录如下表:
加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
1 | 20.0 | 16.0 |
2 | 20.0 | 12.0 |
3 | 20.0 | 8.0 |
4 | 20.0 | 8.0 |
试计算:
(1)10.0g此样品中铜的质量_____。
(2)样品中氧化亚铁的质量分数_____。
(3)所用硫酸溶液溶质的质量分数_____。