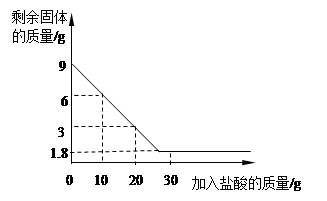题目内容
(7分)某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸。为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加人50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如下图所示。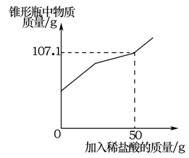
求:(1)9.3g样品中碳酸钠的质量。
(2)未知浓度的稀盐酸的溶质质量分数。
(1)含碳酸钠的质量为5.3g;(2)稀盐酸的质量分数为14.6%
解析试题分析:因固体成分为氢氧化钠和碳酸钠。盐酸先与氢氧化钠反应生成氯化钠和水,此反应过程中不产生气体,为图像中的第一段。氢氧化钠反应完全后,盐酸与碳酸钠反应会生产氯化钠、水和二氧化碳气体。因有气体的产生,造成溶液质量增加幅度比上一个反应小。为图像中的第二段。当碳酸完全时,再加入盐酸,溶液中无反应发生。为图像中的第三段。根据图像可知:当加入稀盐酸的质量为50g时,与碳酸钠恰好完全反应。可根据溶液的总质量求出生成二氧化碳的质量
(1)根据题意可知:已知量为二氧化碳的质量,未知量为碳酸钠的质量。解题思路:可根据化学方程式中二氧化碳与碳酸钠的质量关系,求出碳酸钠的质量。
(2)在(1)中求出碳酸钠的质量,即可求出氢氧化钠的质量。再根据碳酸钠和氢氧化钠的质量分别求出与它们反应的纯盐酸的质量,即可求稀盐酸的质量分数。具体解题过程如下:
解:(1)生成二氧化碳的质量为:9.3g+50g+50g—107.1g=2.2g
设含碳酸钠的质量为x,与碳酸钠反应的纯盐酸的质量为y,与氢氧化钠反应的纯盐酸的质量为z;
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 73 44
x y 2.2g
106:44=x:2.2g
x=5.3g
73:44= y:2.2g
y=3.65g
HCl+NaOH==NaCl+H2O
36.5 40
z (9.3g—5.3g)
36.5:40=z: (9.3g—5.3g)
z=3.65g
稀盐酸的质量分数为: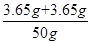 ×100%=14.6%
×100%=14.6%
答:(1)含碳酸钠的质量为5.3g;
(2)稀盐酸的质量分数为14.6%
考点:根据化学方程式的计算

 名校课堂系列答案
名校课堂系列答案在稀硫酸和硫酸铜的混合溶液中,加入适量铁粉,使其恰好反应。,.则原混合溶液中硫酸和硫酸铜的质量比为
| A.7:80 | B.1:1 | C.7:40 | D.49:80 |