题目内容
(3分)为测定NaCl和Na2SO4固体混合物中NaCl的质量分数,化学小组同学进行如下实验活动: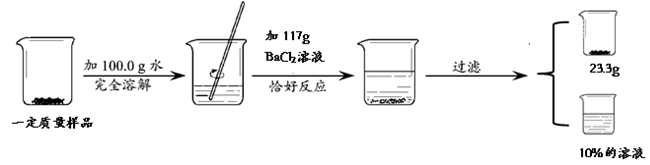
由此测得原固体混合物中NaCl的质量分数是多少?(已知:Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl)
设样品中氯化钠的质量为y,硫酸钠的质量为z,反应生成氯化钠的质量为x
Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl
142 233 117
z 23.3g x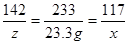
X=11.7g z=14.2g
10%=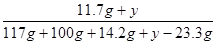 ×100% y=10.1g
×100% y=10.1g
NaCl%= ×100%=41.6%
×100%=41.6%
答:略
解析试题分析:由题意可知,生成的硫酸钡沉淀的质量为23.3g,反应的化学方程式为Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl,利用化学方程式即可求得生成氯化钠的质量和原有硫酸钠的质量;难点是原有氯化钠的质量设为y:已知所得氯化钠溶液质量分数为10%,利用质量守恒定律可得所得溶液的质量为 117g+100g+14.2g—23.3g,溶质为11.7g+y,列式解方程即可求得y;原固体混合物质量即可求得;原固体混合物中NaCl的质量分数即可求得.
考点:化学方程式的计算;溶质质量分数的计算

在天平两边各放一只盛有等质量的相同溶质质量分数的稀硫酸的烧杯,把天平调至平衡,然后在左边烧杯中放入3.3克铝粉,为使天平平衡,向右边的烧杯中应加入镁粉的质量可能是( )
| A.6.6克 | B.3.3克 | C.3.2克 | D.2.4克 |
(7分)经科学检测,蛋壳中含碳酸钙83—85%,蛋白质15—17%,并含有多种微量元素锌、铜、铁、硒等。小波同学为了亲自检测蛋壳中的某些成分以及含量,进行了实验探究。请回答相关问题:
(1)关于蛋壳的叙述中,你认为错误的一项是( )
| A.含钙、锌、铜、铁、硒等微量元素 |
| B.是由无机物和有机物等组成的混合物 |
| C.蛋壳焙干研粉,胃病患者服用,有止痛和治疗胃酸过多的效果 |
| D.可以加工成乳酸钙、葡萄糖酸钙等产品,变废为宝 |
。
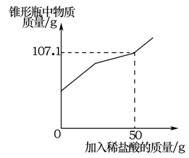
(3)如果实验过程和测定的相关实验数据如下所示:

请根据以上数据计算蛋壳中碳酸钙的质量分数。(写出计算过程,结果精确到0.1%)