题目内容
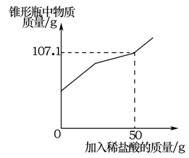
实验室中有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8克10%的氢氧化钠溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:
(1)配制8克10%的氢氧化钠溶液,需要水的质量为 g;
(2)计算该盐酸的溶质质量分数;(写出计算过程)
(3)当滴入4克盐酸时,烧杯内溶液中钠元素的质量为 g。
(1)7.2;(2)7.3%;(3)0.46
解析

练习册系列答案
相关题目
根据右图所提供的信息,下列对该袋食盐的判断不正确的是 
| A.该食盐中氯元素的质量分数最大 |
| B.每袋食盐中碘元素的质量为10 mg |
| C.每袋食盐中含碘酸钾的质量约为16.9 mg |
| D.若仅靠该盐补充碘,成人每天需摄入该食盐5 g |
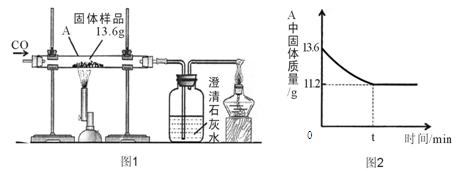
某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表.
附表:实验数据
| | 反应前 | 反应后 | |||
| 实验数据 | 烧杯的质量/g | 稀盐酸的质量/g | 混合物样品的质量/g | 烧杯和其中混合物的质量/g | |
| 40.6 | 123.4 | 12 | 171.6 | | |
(2)样品碳酸钠的质量分数是多少?(最后结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?
(7分)学过金属活动性后,秦思同学通过实验探究锌粉与硝酸亚铁和硝酸银两种盐溶液的反应。实验现象和数据如下: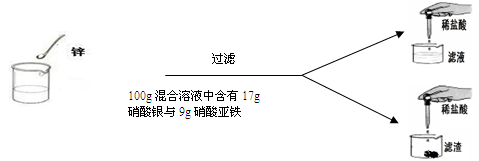
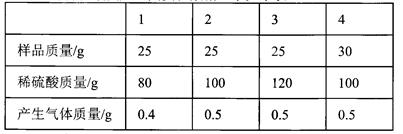
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 硝酸亚铁与硝酸银的混合溶液 | 100g | 100g | 100g | 100g |
| 锌粉 | 2g | 3.25g | m | 9.75g |
| 向滤液中加入稀盐酸后的实验现象 | 产生白色沉淀 | 无明显现象 | 无明显现象 | 无明显现象 |
| 向滤渣中加入100 g稀盐酸后的实验现象 | 无明显现象 | 无明显现象 | 产生气泡,溶液变为浅绿色 | 现象与第三次相同 |
(2)根据第一次的实验现象,你认为此次滤液中的溶质是 ;
(3)根据已知条件列出求解第二次实验中置换出金属银的质量(x)的比例式 ;
(4)若第三次实验锌与两种盐溶液恰好完全反应,则m的质量为__________________;
(5)若向第三次反应后的滤液中加入一定质量的水,所得不饱和溶液中溶质的质量分数为10%,则加入水的质量为__________________;
(6)若用溶质质量分数为36.5%的浓盐酸配制第四次实验中与滤渣恰好完全反应所需的稀盐酸,则需要浓盐酸与水的质量比为_______________。