题目内容
【题目】金属及其化合物在生产生活中有广泛的应用。
(一)金属的应用和防护
(1)飞机的燃料是航空煤油,它主要是由____炼制的(填“石油”或“煤”)。
(2)铁生锈需要同时接触O2和____,请提出生活中铁制品防锈的一种方法____。
(3)特种钢中的Mn可以由MnO2和Al粉混合在高温下通过置换反应制得,该化学方程式为____。
(4)Mg(OH)2受热分解生成MgO,Mg(OH)2用作阻燃剂,其原理是____(填字母)。
A 分解吸热,降低环境温度 B MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
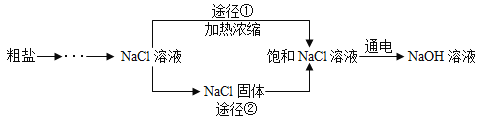
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
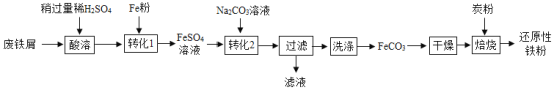
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为____。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,除去CO32-,再滴加____溶液,无明显现象。
(3)“干燥”发生转化:FeCO3 ![]() FeOOH+CO2,该转化的化学方程式为____。
FeOOH+CO2,该转化的化学方程式为____。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是____。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:① Fe,FexCy在加热时与O2反应能生成Fe2O3和CO2。
②FexCy不与酸反应。
实验1:取30.48g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取30.48g样品,按下图进行实验。
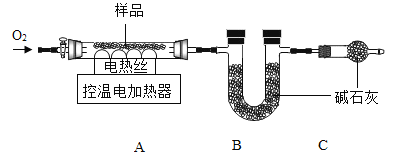
表:装置A和B的质量变化
装置 | A | B |
反应前 | 400.00g | 400.00g |
反应后 | mg | 400.88g |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要____。
(2)装置C的作用是____。
(3)FexCy中,x:y=____。表中m的值是____g。
(实验反思):若用空气(除去CO2)的替代O2进行实验,测得x:y的值偏大,可能的原因是____。
【答案】石油 H2O 涂漆等(合理即可) 3MnO2+4Al![]() 3Mn+2Al2O3 B Fe2(SO4)3+Fe=3FeSO4 氯化钡(BaCl2)或硝酸钡[Ba(NO3)2] 4FeCO3+2H2O+O2=4FeOOH+4CO2 增大反应物接触面积,使反应更快更充分 检查装置气密性 防止空气中的CO2和H2O进入到B装置 2:1 412.72[400+12.96(O)-0.24(C)或者400-30.48+43.2(Fe2O3)] Fe2C中部分C未完成燃烧生成了CO,无法被装置B吸收,导致C质量减小
3Mn+2Al2O3 B Fe2(SO4)3+Fe=3FeSO4 氯化钡(BaCl2)或硝酸钡[Ba(NO3)2] 4FeCO3+2H2O+O2=4FeOOH+4CO2 增大反应物接触面积,使反应更快更充分 检查装置气密性 防止空气中的CO2和H2O进入到B装置 2:1 412.72[400+12.96(O)-0.24(C)或者400-30.48+43.2(Fe2O3)] Fe2C中部分C未完成燃烧生成了CO,无法被装置B吸收,导致C质量减小
【解析】
(一)(1)飞机的燃料是航空煤油,它主要是由石油炼制的;
(2)铁生锈需要同时接触O2和水,防止铁生锈的方法:涂漆、涂油、镀一层金属等;
(3)MnO2和Al粉混合在高温下反应可得到Mn和氧化铝,该反应的化学方程式为:3MnO2+4Al![]() 3Mn+2Al2O3;
3Mn+2Al2O3;
(4)Mg(OH)2受热分解生成高熔点的MgO,Mg(OH)2可用作阻燃剂,其主要原理是MgO覆盖燃烧物、隔绝氧气。故选B;
(二)(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为:Fe2(SO4)3+Fe=3FeSO4;
(2)根据流程图可知,若FeCO3未洗净则沉淀表面附有硫酸钠,硫酸钠与氯化钡溶液或硝酸钡溶液生成硫酸钡的沉淀。检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加氯化钡溶液或硝酸钡溶液,无明显现象,说明已经洗的干净;
(3)根据“干燥”发生转化:FeCO3 ![]() FeOOH+CO2可知,该转化的反应物是FeCO3、H2O和O2,生成物是FeOOH和CO2,化学方程式为:4FeCO3+2H2O+O2=4FeOOH+4CO2;
FeOOH+CO2可知,该转化的反应物是FeCO3、H2O和O2,生成物是FeOOH和CO2,化学方程式为:4FeCO3+2H2O+O2=4FeOOH+4CO2;
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是增大反应物接触面积,加快反应速率;
(三)(1)为防止装置漏气,影响实验结果,装配好装置后,实验前先要检查装置气密性;
(2)装置C的作用是防止空气中的CO2和H2O进入到B装置,影响实验结果;
(3)设30.48g样品中铁质量为x,
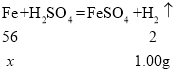
![]()
x=28g,
30.48g样品中FexCy质量:30.48g-28g=2.48g,
FexCy中碳元素质量:(400.88g-400.00g)![]() ×=0.24g,铁元素质量:2.48g-0.24g=2.24g,根据题意有:
×=0.24g,铁元素质量:2.48g-0.24g=2.24g,根据题意有:![]() ,x:y=2:1,
,x:y=2:1,
设铁元素结合氧元素质量为z,铁元素质量:28g+2.24=30.24g,
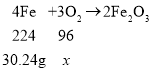
![]()
z=12.96g,
表中m的值是:400.00+12.96-0.24=412.72g,
[实验反思]:若用空气替代O2进行实验,Fe2C中部分C生成了CO,无法被装置B吸收,导致C的质量减小,x:y的值偏大。

【题目】氧气是我们身边无法离开的物质。某兴趣小组对氧气的研究如下:
I.氧气的制备:
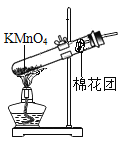
(1)该装置中棉花团的作用是________,图中装置一处明显的错误是________。
II.氧气的收集:
[实验1]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
[实验2]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
[实验3]用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据
(2)由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是________。
(3)不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是___。
Ⅲ.铁丝在氧气中燃烧
(4)铁丝燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是________(填化学式)。将燃烧后的黑色固体粉碎后,滴加稀硫酸,若产生气泡,则原因是__________(用化学反应方程式表示)。