题目内容
【题目】从铁粉、氧化铜、稀盐酸、氢氧化钠、氯化钡、氯化铁和硫酸钠等固体或溶液中,按条件选择反应物书写化学方程式。
(1)有氢气生成的置换反应_____。
(2)有水生成的非中和反应____。
(3)验证硫酸根离子的反应____。
(4)有红褐色沉淀生成的反应_____。
【答案】![]()
![]()
![]()
![]()
【解析】
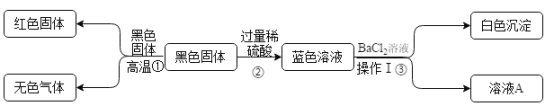
(1)有氢气生成的置换反应为铁粉与稀盐酸的反应,铁与稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为![]() 。
。
(2)有水生成的非中和反应为氧化铜与稀盐酸的反应,氧化铜与稀盐酸反应生成氯化铜和水,反应的化学方程式为![]() 。
。
(3)利用钡离子与硫酸根反应生成硫酸钡白色沉淀来验证硫酸根离子,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,反应的化学方程式为![]() 。
。
(4)氢氧化铁是红褐色沉淀,氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为![]() 。
。

【题目】疫情期间宅出“面点热”,发酵粉一时成为很多网友热议的话题,很多人在假期迷上了做包子、油条、手撕面包等面食,根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠能与酸反应。碳酸氢钠的俗称叫_______。发酵粉的主要成分中含有碳酸氢钠,某化学兴趣小组的同学对碳酸氢钠的性质进行了探究。
Ⅰ.定性探究
一.探究碳酸氢钠的热稳定性
(查阅资料]碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
(实验1)取一定质量的碳酸氢钠放到铜片上加热,如图所示。
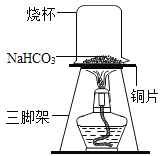
(1)加热一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是_______。
(3)欲通过进一步的实验探究来确定充分加热后的固体产物的成分。
①可能是Na2CO3②可能是NaOH ③可能是_______
(实验2)
实验操作 | 实验现象 | 实验结论 |
A.将该固体溶于蒸馏水配制成溶液,取少量溶液于试管中,滴加足量稀盐酸 | 有气体产生 | 假设_______(填序号)不成立 |
B.另取少量溶液于试管中,滴加足量的氯化钡溶液 | _______ | 固体产物中有Na2CO3 |
C.取上述B步骤静置后所得上层清液,滴入少量_______溶液 | 无明显现象 | 假设①成立 |
(实验结论)NaHCO3受热分解的化学方程式为_______。
(延伸拓展)实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,为了鉴别碳酸钠和碳酸氢钠两种白色固体,设计了不同的方法做了以下实验,如下图所示:
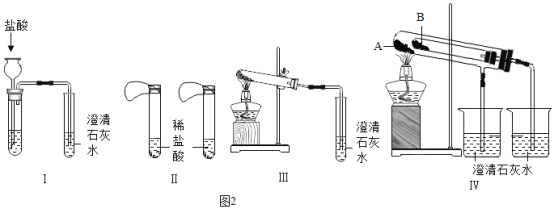
(1)图I、II、Ⅲ、IV所示实验方案中,能够达到实验目的的是(填装置序号)_______。
(2)实验IV在试管B中装入的固体最好是_______。
Ⅱ.定量探究
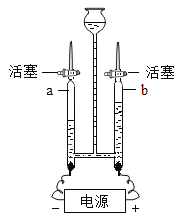
为测定某发酵粉中碳酸氢钠的质量分数(杂质不与酸反应),按如图组装仪器(装置气密性良好),取50g样品放入锥形瓶中,计了如下实验,其主要实验步骤如下:
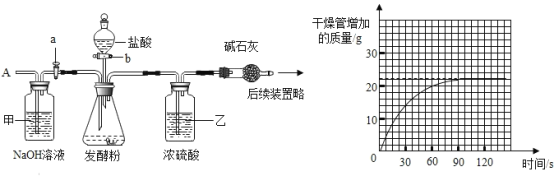
正确的顺序是________(填序号,可重复选择)
a 称量干燥管内碱石灰(氧化钙和氢氧化钠固体的混合物)的质量
b 关闭塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气;
c 关闭活塞a,打开活塞b,加入足量稀盐酸溶液,直至锥形瓶内不再产生气泡;
(1)装置甲的作用是_______,装置乙的作用是_______;
(2)请利用图中相关数据计算样品中碳酸氢钠的质量分数________(写出计算过程)。
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
(查得资料)
(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
(2)饱和碳酸氢钠溶液不吸收二氧化碳。
(3)碱石灰的主要成分为氧化钙和氢氧化钠。
(设计实验)小组同学设计了如图所示装置(图中夹持仪器略去)测定牙膏样品中碳酸钙的含量。
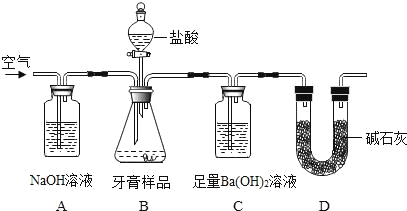
依据图示回答下列问题:
(1)B装置使用分液漏斗的优点是_____。
(2)A中氢氧化钠溶液的作用是_____。
(3)C中观察到有沉淀产生,反应的化学方程式为_____。
(4)实验过程中需持续缓缓通入空气,其作用有_____。
(解释与结论)将C中产生沉淀通过_____、洗涤、干燥、称量,通过计算求得牙膏样品中碳酸钙的含量。
(反思与评价)
反思实验过程,小刚同学提出应采取必要措施,提高测定准确度。他提出的下列各项措施中,不能提高测定准确度的是_____(填字母序号)。
a 在加入盐酸之前,排净装置内的CO2气体
b 放慢滴加盐酸的速度
c 在A﹣B之间增添盛有浓硫酸的洗气装置
d 在B﹣C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(拓展延伸)小亮同学为确定A中溶质成分,进行了如表所示实验:
实验操作 | 实验现象 | 实验结论 |
(1)、取少量滤液于试管中,加入足量____ | 产生白色沉淀 | 溶质主要成分为Na2CO3和NaOH |
(2)、过滤,取少量滤液加入 | _____ |
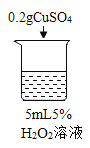
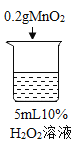
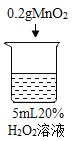
【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
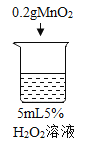
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰