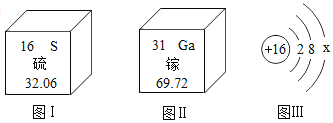
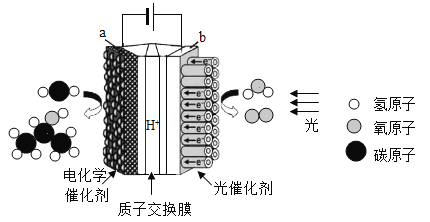
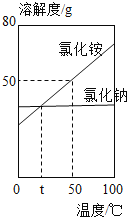
题目内容
【题目】氯化钙应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产CaCl2,的流程如下:
![]()
(1)氧化铁和盐酸反应的化学方程式为_____
(2)滤液1中的溶质有HCl、FeCl3、MgSO4和_____
(3)写出滤液1中加入BaCl2发生的化学反应方程式:_____
(4)滤液2中加入Ca(OH)2可以除去HCl、MgCl2和_____
(5)滤液3呈碱性,为使溶液pH降低,可加入适量的_____
【答案】Fe2O3+6HCl=2FeCl3+3H2O CaCl2 MgSO4+BaCl2=BaSO4↓+MgCl2 FeCl3 稀盐酸
【解析】
石灰石的主要成分是碳酸钙,该物质中含有杂质氧化铁和硫酸镁。
加入过量的稀盐酸后,碳酸钙和稀盐酸反应,生成氯化钙、水和二氧化碳。氧化铁和稀盐酸反应生成氯化铁和水。则该滤液1中含有氯化钙、氯化铁、硫酸镁、盐酸。
加入适量的氯化钡后,氯化钡可以将溶液中的硫酸镁除去,氯化钡和硫酸镁反应生成氯化镁和硫酸钡沉淀。则经过过滤后,滤液2中含有氯化钙、氯化铁、氯化镁、盐酸。
加入过量的氢氧化钙后,氢氧化钙和盐酸优先反应,生成氯化钙和水。氢氧化钙和氯化铁反应,生成氢氧化铁沉淀和氯化钙。氢氧化钙和氯化镁反应,生成氢氧化镁沉淀和氯化钙。则经过过滤后,滤液3中含有氯化钙、氢氧化钙。
通过调节pH值,将氢氧化钙转化为氯化钙,即得到产品。
根据以上分析可知:
(1)氧化铁和盐酸反应,生成氯化铁和水。故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)通过分析可知,滤液1中,含有氯化钙、氯化铁、硫酸镁和盐酸。故答案为:CaCl2;
(3)通过分析可知,向滤液1中加入氯化钡后,氯化钡和硫酸镁反应,生成硫酸钡沉淀和氯化镁。故答案为:MgSO4+BaCl2=BaSO4↓+MgCl2;
(4)通过分析可知,向滤液2中加入氢氧化钙,可以除去盐酸、氯化镁和氯化铁。故答案为:FeCl3;
(5)通过分析可知,滤液3的溶质为氯化钙和氢氧化钙。为了调节pH,使其降低,则可以加入酸性物质。加入该物质后,不仅能降低pH,而且能将氢氧化钙转化为氯化钙得到产品,则可以分析出加入的物质可能是稀盐酸。氢氧化钙和稀盐酸反应生成氯化钙和水。故答案为:稀盐酸。

【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A. 实验①所得溶液质量分数为10%
B. 实验说明25℃时该物质的溶解度是20g
C. 实验③④所得溶液质量分数相同
D. 实验④所得溶液中含溶质20g
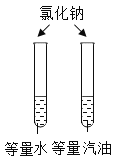
【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的是( )
编号 | ① | ② | ③ | ④ |
实验设计 |
|
|
|
|
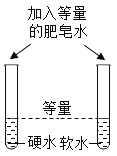
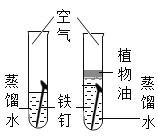
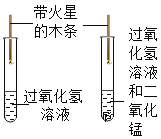
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 区分硬水和软水 | 探究铁生锈的条件 | 研究二氧化锰的催化作用 |
A.①B.②C.③D.④