题目内容
【题目】疫情期间宅出“面点热”,发酵粉一时成为很多网友热议的话题,很多人在假期迷上了做包子、油条、手撕面包等面食,根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠能与酸反应。碳酸氢钠的俗称叫_______。发酵粉的主要成分中含有碳酸氢钠,某化学兴趣小组的同学对碳酸氢钠的性质进行了探究。
Ⅰ.定性探究
一.探究碳酸氢钠的热稳定性
(查阅资料]碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
(实验1)取一定质量的碳酸氢钠放到铜片上加热,如图所示。
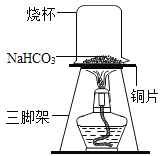
(1)加热一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是_______。
(3)欲通过进一步的实验探究来确定充分加热后的固体产物的成分。
①可能是Na2CO3②可能是NaOH ③可能是_______
(实验2)
实验操作 | 实验现象 | 实验结论 |
A.将该固体溶于蒸馏水配制成溶液,取少量溶液于试管中,滴加足量稀盐酸 | 有气体产生 | 假设_______(填序号)不成立 |
B.另取少量溶液于试管中,滴加足量的氯化钡溶液 | _______ | 固体产物中有Na2CO3 |
C.取上述B步骤静置后所得上层清液,滴入少量_______溶液 | 无明显现象 | 假设①成立 |
(实验结论)NaHCO3受热分解的化学方程式为_______。
(延伸拓展)实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,为了鉴别碳酸钠和碳酸氢钠两种白色固体,设计了不同的方法做了以下实验,如下图所示:
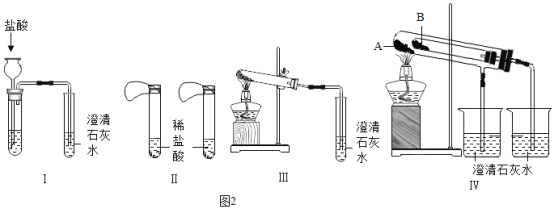
(1)图I、II、Ⅲ、IV所示实验方案中,能够达到实验目的的是(填装置序号)_______。
(2)实验IV在试管B中装入的固体最好是_______。
Ⅱ.定量探究
为测定某发酵粉中碳酸氢钠的质量分数(杂质不与酸反应),按如图组装仪器(装置气密性良好),取50g样品放入锥形瓶中,计了如下实验,其主要实验步骤如下:
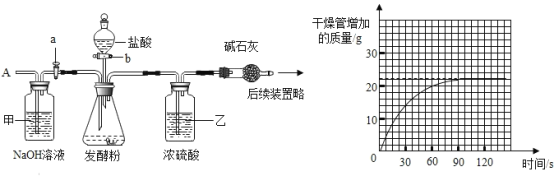
正确的顺序是________(填序号,可重复选择)
a 称量干燥管内碱石灰(氧化钙和氢氧化钠固体的混合物)的质量
b 关闭塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气;
c 关闭活塞a,打开活塞b,加入足量稀盐酸溶液,直至锥形瓶内不再产生气泡;
(1)装置甲的作用是_______,装置乙的作用是_______;
(2)请利用图中相关数据计算样品中碳酸氢钠的质量分数________(写出计算过程)。
【答案】小苏打 CO2 NaOH、Na2CO3 ② 有白色沉淀产生 酚酞(或硫酸铜溶液等) ![]() Ⅱ、Ⅲ、Ⅳ NaHCO3 b a c b a 除去空气中的CO2 吸收水,干燥CO2 84%
Ⅱ、Ⅲ、Ⅳ NaHCO3 b a c b a 除去空气中的CO2 吸收水,干燥CO2 84%
【解析】
碳酸氢钠的俗称是小苏打;
Ⅰ.定性探究
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是CO2;
(3)根据质量守恒定律推断,充分加热后的固体产物可能是氢氧化钠、碳酸钠或氢氧化钠和碳酸钠的混合物;
实验2
实验A:将该固体溶于蒸馏水配制成溶液,取少量溶液于试管中,滴加足量稀盐酸,有气体产生,碳酸钠和稀盐酸反应生成二氧化碳,说明固体中有碳酸钠,则假设②不成立;
实验B:另取少量溶液于试管中,滴加足量的氯化钡溶液,有白色沉淀产生,碳酸钠和氯化钡反应生成碳酸钡白色沉淀和氯化钠,说明固体产物中有碳酸钠;
实验C:取上述B步骤静置后所得上层清液,滴入少量酚酞溶液,若固体中含有氢氧化钠,则溶液变红,若无明显现象,说明无氢氧化钠,实验现象是无明显现象,则假设①成立;
实验结论:
根据上述分析可知,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,化学方程式为:![]() ;
;
延伸拓展:
(1)碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水,所以都能使澄清石灰水变浑浊,图I不能鉴别;碳酸钠和碳酸氢钠都能和稀盐酸反应,但碳酸氢钠反应速率较快,产生气泡的速率较快,图II能鉴别;碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,能使澄清的石灰水变浑浊,碳酸钠受热不反应,图III能鉴别;图IV和图III原理一样,能使澄清的石灰水变浑浊的是碳酸氢钠,也能鉴别;
(2)实验IV在试管B中装入的固体最好是NaHCO3,因为外试管温度大于内试管温度,若内试管中的碳酸氢钠分解了,那外试管中碳酸钠若能分解也已经分解,澄清石灰水没变化,说明碳酸钠不能分解;
Ⅱ.定量探究
若按图中装置测定某发酵粉中碳酸氢钠的质量分数,应先关闭塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气,然后称量干燥管内碱石灰的质量,再关闭活塞a,打开活塞b,加入足量稀盐酸溶液,直至锥形瓶内不再产生气泡,关闭塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气,将装置内的二氧化碳都让碱石灰吸收,再次称量干燥管内碱石灰的质量,故正确的顺序是b a c b a;
(1)装置甲的作用是除去空气中的CO2,装置乙的作用是吸收水,干燥CO2;
(2)根据图中信息可知,碱石灰增加的质量是22g,则二氧化碳的质量是22g,设样品中碳酸氢钠的质量为x
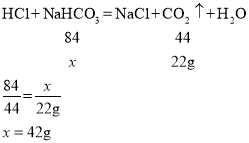
则样品中碳酸氢钠的质量分数![]() 。
。

【题目】镁条在空气中久置表面会变黑,某小组同学设计并进行实验探究镁条变黑的条件。
【查阅资料】碱石灰可吸收二氧化碳和水。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关
【进行实验】通过控制与镁条接触的物质,利用如图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 1 | 2 | 3 | 4 | 5 |
实验 |
|
|
|
|
|
现象 | 无明显变化 | 无明显变化 | 无明显变化 | 无明显变化 | 20天后镁条变黑 |
【解释与结论】
(1)实验1的目的是________。
(2)实验2中,NaOH溶液吸收空气中二氧化碳的化学方程式是________。
(3)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是________。(填编号)
(4)由上述实验可推知,镁条变黑的条件是________。
【反思与评价】
(5)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是________。