题目内容
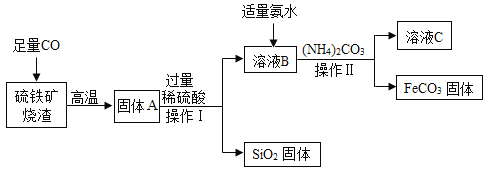
【题目】碳酸亚铁(FeCO3)可用于制作补铁药物,以下是用硫铁矿烧渣(主要成分为 Fe2O3、SiO2 等)为原料制备碳酸亚铁的生产流程示意图:
[资料]40℃以上时,(NH4)2CO3 易分解
(1)操作 I 所用到的玻璃仪器有烧杯、玻璃棒和 _____。
(2)加入(NH4)2CO3 后,该反应必须控制的条件是 _____。
(3)从溶液 C 中可回收一种化工产品——(NH4)2SO4,请写出它的一种用途: _____。
【答案】漏斗 温度不超过40℃ 氮肥(或化肥)
【解析】
(1)操作 I是过滤操作,因此所用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(2)因为40℃以上时,(NH4)2CO3 易分解,所以加入(NH4)2CO3 后,该反应必须控制的条件是:温度不超过40℃。
(3)硫酸亚铁和碳酸铵反应生成FeCO3和(NH4)2SO4,过滤后,(NH4)2SO4存在于溶液C中,所以溶液C中可回收一种化工产品——(NH4)2SO4,(NH4)2SO4中含氮元素,因此它的一种用途是:氮肥(或化肥)。

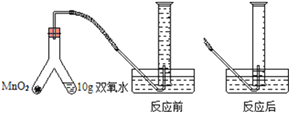
【题目】为了测定某医用双氧水中H2O2的浓度,某兴趣小组取10g样品设计如图装置进行实验(实验在常温下进行,O2在水中的溶解情况忽略不计,密度为1.43g/L),实验数据如下:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 |
量筒 读数/mL | 0 | 32 | 60 | 80 | 90 | 95 | 98 | 100 | 98 | 94 | 90 | 90 |
(1)实验开始,将MnO2和双氧水混合,操作方法是______。
(2)反应结束,共制得氧气______mL。
(3)列式计算双氧水中H2O2的溶质质量分数___。(保留到0.01%)
(4)根据表中数据,画出产生O2的体积随时间的变化关系____;70s后测得气体体积逐渐变小的原因是:______。