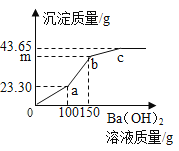
��Ŀ����
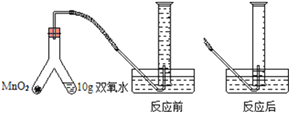
����Ŀ��Ϊ�˲ⶨijҽ��˫��ˮ��H2O2��Ũ�ȣ�ij��ȤС��ȡ10g��Ʒ�����ͼװ�ý���ʵ�飨ʵ���ڳ����½��У�O2��ˮ�е��ܽ�������Բ��ƣ��ܶ�Ϊ1.43g/L����ʵ���������£�
ʱ��/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 |
��Ͳ ����/mL | 0 | 32 | 60 | 80 | 90 | 95 | 98 | 100 | 98 | 94 | 90 | 90 |
��1��ʵ�鿪ʼ����MnO2��˫��ˮ��ϣ�����������______��
��2����Ӧ���������Ƶ�����______mL��
��3����ʽ����˫��ˮ��H2O2��������������___����������0.01%��
��4�����ݱ������ݣ���������O2�������ʱ��ı仯��ϵ____��70s�������������С��ԭ���ǣ�______��

���𰸡���Y����б��MnO2����˫��ˮ�У���Y����б��˫��ˮ����MnO2�У� 90 2.73% 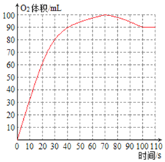 ˫��ˮ��MnO2����ʱ�¶����ߣ���Ӧ�������¶Ƚ������£����������С
˫��ˮ��MnO2����ʱ�¶����ߣ���Ӧ�������¶Ƚ������£����������С
��������
(1)��ͼ��֪��MnO2��˫��ˮ�ֱ���Y�ܵ����ˣ�Ҫ������ϣ����������ǰ�Y����б��MnO2����˫��ˮ�У���Y����б��˫��ˮ����MnO2�У���
(2)�ɱ���֪������ʱ��110sʱ���ռ������������Ϊ90mL���ʷ�Ӧ���������Ƶ�����90mL��
(3)
˫��ˮ��H2O2��������������Ϊ��![]() ��100%=2.73%��
��100%=2.73%��
(4) 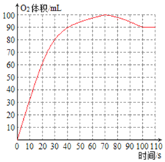
70s�������������С��ԭ���ǣ�˫��ˮ��MnO2����ʱ�¶����ߣ���Ӧ�������¶Ƚ������£����������С��

 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�