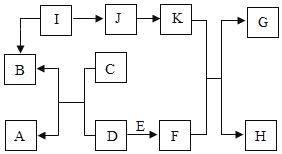
题目内容
【题目】二氧化硫(SO2)在通常情况下是一种无色、有刺激性气味的有毒气体,是造成酸雨的原因之一,它能与氢氧化钠溶液反应生成盐和水。实验室可用亚硫酸钠(Na2SO3)及硫酸制取二氧化硫,某实验小组的同学欲利用下列装置和药品制取二氧化硫,并对二氧化硫与水在通常情况下能否发生化学反应进行实验探究,设计的探究过程如下,请回答有关问题。

(1)A装置中分液漏斗也可用长颈漏斗代替,与长颈漏斗相比,分液漏斗的好处是_____:
(2)写一个实验室用A装置制取密度小于空气的气体化学方程式_____.
(3)I假设:二氧化硫与水在通常情况下能发生化学反应,生成物是一种酸性物质。
Ⅱ设计方案:先验证水能否使蓝色石蕊试纸变色;再验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色;最后验证二氧化硫气体能否使湿润的蓝色石蕊试纸变色。
Ⅲ查阅资料:a.二氧化硫易溶于水;酸能使湿润的蓝色石蕊试纸变红;二氧化硫能被浓硫酸干燥
Ⅳ进行实验:
①请补全B装置中导管位置。_____
②实验过程中,装置C内石蕊试纸的颜色始终没有变化,这说明什么?_____
③装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红,此现象说明什么?_____
④请写出装置E的作用_____
V结论:原假设_____(填“成立“或“不成立)。
(4)某食用碱的主要成分是碳酸钠,其中含少量氯化钠。向盛有6g食用碱的烧杯内加入足量的水,搅拌后加入过量的氯化钙,充分反应后过滤得到滤渣5.0g。请计算该食用碱中氯化钠的质量分数是多少?_____(计算结果精确至0.1%)
【答案】便于控制反应速率 Zn+H2SO4=ZnSO4+H2↑ 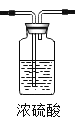 二氧化硫不能使石蕊变色 二氧化硫与水反应生成酸性物质使石蕊变色 尾气处理,防止二氧化硫逸散到空气中导致大气污染 成立 11.7%
二氧化硫不能使石蕊变色 二氧化硫与水反应生成酸性物质使石蕊变色 尾气处理,防止二氧化硫逸散到空气中导致大气污染 成立 11.7%
【解析】
(1)A装置中分液漏斗也可用长颈漏斗代替,与长颈漏斗相比,分液漏斗的好处是:便于控制反应速率;
(2)装置A属于固液混合常温型发生装置,适宜用锌与稀硫酸反应制取氢气,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
(3)①实验室用亚硫酸钠(Na2SO3)及硫酸制取二氧化硫,所得二氧化硫气体是湿润的,需经过浓硫酸进行干燥,故气体应通入浓硫酸,因此二氧化硫气体应“长进短出”,故B装置中导管位置如图: ;
;
②实验过程中,装置C内干燥的石蕊试纸的颜色始终没有变化,这说明:二氧化硫不能使石蕊变色;
③装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红,此现象说明:二氧化硫与水反应生成酸性物质使石蕊变色;
④装置E中呈碱性的装氢氧化钠溶液,能够与酸性物质反应,而二氧化硫与水反应生成酸性物质,故装置E的作用是:尾气处理,防止二氧化硫逸散到空气中导致大气污染;
V结论:原假设成立;
(4![]() 设要生成5g沉淀需要碳酸钠质量为x。
设要生成5g沉淀需要碳酸钠质量为x。
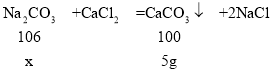
![]()
x=5.3g
所含氯化钠的质量=6g-5.3g=0.7g
该食用碱中氯化钠的质量分数=![]() ×100%=11.7%。
×100%=11.7%。

【题目】李阿姨很喜欢在网上淘宝,昨天她在网上买了一枚金戒指,比市场的价格要便宜很多,她既高兴又担心戒指是假的。于是她邀请你所在的化学兴趣小组的同学帮她测定戒指的真假。 查阅资料可知:假金(俗称黄铜,单纯从颜色、外形上看,与黄金极为相似,所以很难区分)是Zn、Cu合金,真金是Au(不考虑黄铜中的其他杂质)在托盘天平上称量这枚金戒指正好15g,将该金戒指放人烧杯中,用量筒量取75 mL稀盐酸分五次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀盐酸的体积/mL | 15 | 15 | 15 | 15 | 15 |
生成氢气的质量/g | 0. 04 | 0. 04 | 0. 04 | N | 0. 02 |
试求:
(1)由表中的数据我们可知:该金戒指为________(填“真”或“假”)
(2)N的数值为________。
(3)此金戒指中铜的质量分数是多少?_________(写出计算过程)
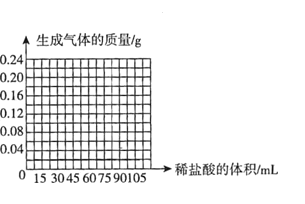
(4)请在下图中画出向这枚15g金戒指中加稀盐酸的体积与产生气体质量变化关系的示意图。______