题目内容
【题目】工业制取硝酸的流程如图:
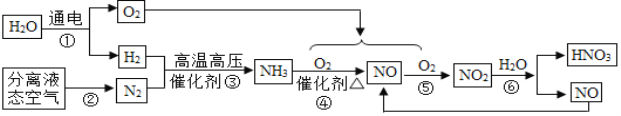
(1)步骤①是通过电解水制取氢气,是_____变化(填“物理”或“化学”)。
(2)步骤④的化学方程式为4NH3+5O2![]() 4NO+6X,X的化学式为_____,HNO3中N的化合价是_____
4NO+6X,X的化学式为_____,HNO3中N的化合价是_____
(3)步骤③是化合反应,写出③的化学方程式为_____。
(4)流程中可以循环使用的物质是_____(写化学式)。
【答案】化学 H2O +5 3H2+N2![]() 2NH3 NO
2NH3 NO
【解析】
(1)水在通电的条件下生成氢气和氧气,有新物质生成,属于化学变化;
(2)化学反应前后,原子个数、元素种类不变,反应物中有4个氮原子,12个氢原子,1个氧原子,生成物中有4个氮原子、4个氧原子,所以X是H2O;氢元素显+1价,氧元素显-2价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价;
(3)氮气和氢气在催化剂、高温高压的条件下生成氨气,化学方程式为:3H2+N2![]() 2NH3;
2NH3;
(4)既是反应物,也是生成物的物质可以循环使用,一氧化氮也有毒,所以流程中一定要循环使用的物质是NO。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目