题目内容
【题目】a、b、c三种物质的溶解度曲线如图所示,请回答下列问题:
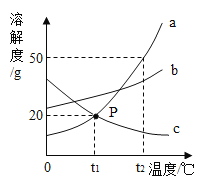
(1)P点表示的含义是_____;
(2)a物质中混有少量b物质时,可用_____方法提纯a物质(填“降温结晶”或“蒸发结晶”)。
(3)要使接近饱和的c溶液变成饱和溶液,可采用的方法有_____ (写一种)。
【答案】在t1℃时,a、c两物质的溶解度相等,且均为20g 降温结晶 增加溶质c(或减少溶剂或升高温度)
【解析】
根据题目信息和溶解度曲线可知:a、b两种固体物质的溶解度,都是随温度升高而增大,而c的溶解度随温度的升高而减少;P点表示的含义是:在t1℃时,a、c两物质的溶解度相等,且均为20g;a物质中混有少量b物质时,可用降温结晶方法提纯a物质;要使接近饱和的c溶液变成饱和溶液,可采用的方法有:增加溶质c、减少溶剂、升高温度。
(1)P点表示的含义是:在t1℃时,a、c两物质的溶解度相等,且均为20g;故答案为:在t1℃时,a、c两物质的溶解度相等,且均为20g。
(2)a物质中混有少量b物质时,可用降温结晶方法提纯a物质,因为a的溶解度随温度的升高变化比b大。
(3)要使接近饱和的c溶液变成饱和溶液,可采用的方法有:增加溶质c、减少溶剂、升高温度。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】某同学对CaH2的制备和性质进行探究。
(阅读资料)①用H2与钙加热制得CaH2
②钙遇水立即发生剧烈反应生成Ca(OH)2和H2
③CaH2要密封保存,遇水反应也生成Ca(OH)2和H2
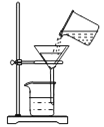
(CaH2的制备)设计的制取装置如图所示:
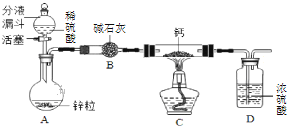
(1)装置B的作用是________________;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显__________色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是_______。
(CaH2的性质探究)
取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ________ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ________ | 猜想三成立 |
(定量分析)
(4)取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为____
(反思与交流)
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是:____。
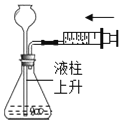
(6)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算CaH2纯度,结果纯度的测定值偏____。(填“偏低”“偏高”或“不变”)