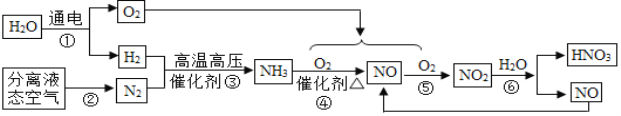
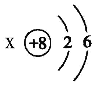题目内容
【题目】水是人类宝贵的自然资源,与人类的生产、生活密切相关。
(1)水是常见的溶剂,将下列生活中的物质分别放入水中,不能形成溶液的是_____。
A 蔗糖 B 纯碱 C 食盐 D 花生油
用质量分数为20%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_____克。
(2)净化水的常用方法有:①消毒杀菌②过滤③蒸馏④活性炭吸附⑤加明矾吸附沉降。天然水中往往含有许多杂质,要把天然水净化成生活中的自来水,所选用的净化方法按净化过程排序是_____(填序号)。
(3)漂白粉可用于水的杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2].次氯酸钙可发生如下反应:Ca(ClO) 2+X+H2O=CaCO3+2HClO,则X的化学式为_____。
(4)一种新型净水剂高铁酸钾(KFeO4),具有高效消毒作用,该高铁酸钾中铁元素的化合价为_____。
(5)工业上可用海水提取粗盐后的母液来提取金属镁,其流程如图:
![]()
该流程中,加溶液A时所发生的反应方程式为_____,其中没有发生的基本反应类型为化合反应和_____。
【答案】D 75g ⑤②④① CO2 +6 Mg(OH)2+2HCl=MgCl2+2H2O 置换反应
【解析】
(1)蔗糖、纯碱和食盐都能溶于水,形成溶液,而花生油不能溶于水,不能形成溶液;
设需加水的质量为x,则 (100g﹣x)×20%=100g×5% ,则x=75g。
(2)将混有杂质的天然水净化成生活用的自来水,加明矾吸附沉降是把水中小颗粒泥尘聚集成大的,以利于沉降;不溶性小颗粒固体杂质可以通过过滤除去;活性炭吸附,可以吸附水中的色素和异味等;投药消毒杀菌可以除去细菌微生物;所以所选用的净化方法按净化过程排序是⑤②④①。
(3)由于在化学反应前后原子的种类及数目不变,生成物中含有1个Ca,1个C,5个O,2个H,2个Cl,反应物中已有1个Ca,3个O,2个H,2个Cl,所以在反应物中还缺少1个C,2个O,所以X的化学式为:CO2。
(4)由于氧显﹣2价,钾显+1价。可以推出在KFeO4中铁的化合价为+6价。
(5)由工业上用海水提取粗盐后的母液来提取金属镁的流程图可知,加入的试剂A是稀盐酸,与氢氧化镁发生反应生成了氯化镁和水,反应的化学方程式是:
![]() ,其中没有涉及到的反应类型是置换反应和化合反应。
,其中没有涉及到的反应类型是置换反应和化合反应。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。
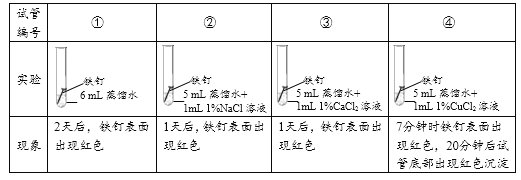
(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。