题目内容
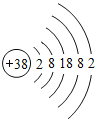
【题目】将一定质量的NaOH溶液与Na2CO3溶液中加入稀盐酸,产生气体与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
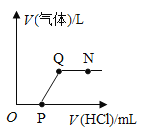
A.N 点时,所得溶液的pH=7
B.N点时,所得溶液中的溶质只含有NaCl
C.O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O
D.Q至N段发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2
【答案】C
【解析】
A、由图可知,N点时,稀盐酸过量,故溶液显酸性,所得溶液的pH<7,不符合题意;
B、氢氧化钠与稀盐酸反应生成氯化钠和水,碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,N点时,稀盐酸过量,故N点时,所得溶液中的溶质有NaCl、HCl,不符合题意;
C、O至P段无气体生成,发生的反应为氢氧化钠与稀盐酸反应生成氯化钠和水,该反应的化学方程式为:![]() ,符合题意;
,符合题意;
D、由图可知,Q至N段,气体体积不再变化,这时反应已经完成,没有发生反应,不符合题意。
故选C。

【题目】NaHCO3在生产和生活中有许多重要用途,某学习小组对其性质进行了如下探究。物质的溶解度见下表。回答下列问题:
温度 | 10℃ | 20℃ |
NaHCO3的溶解度(g/100g水) | 8.1 | 9.6 |
Ca(HCO3)2的溶解度(g/100g水) | 16.6 |
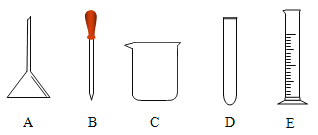
(1)在20℃时称取4gNaHCO3加入46mL蒸馏水(密度取值为lg/mL),充分搅拌制得澄清溶液。该实验可以达到探究NaHCO3____性的目的;实验中不需要的仪器是___(选填字母编号)。
(2)用pH计测得溶液的pH为8.2,说明溶液呈_______性。
(3)所配NaHCO3溶液的质量分数等于_____,降温到10℃时溶液___(填“是”或“不是”)饱和溶液
(4)取2mL所配NaHCO3溶液于试管中,滴加5%的CaCl2溶液,观察到气泡和白色沉淀,实验证明该气体是CO2。据此小组同学讨论认为:白色沉淀不可能是Ca(OH)2,其理由是_____,于是得出结论:白色沉淀是___。