题目内容
【题目】经过氧气和二氧化碳的学习,你已经掌握了很多关于制取气体的有关知识。请完成以下探究:

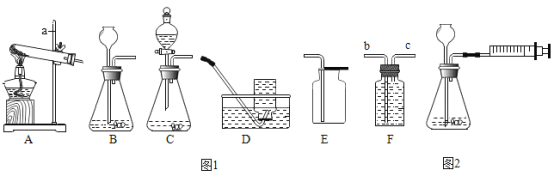
(1)A装置中①仪器的名称是_____。实验室用该装置制取氧气的化学方程式为_____。
(2)关闭K2和K3,打开K1,要收集一瓶二氧化碳,则装置B应与F中的_____端相连。实验室制取二氧化碳一般有如下步骤:①检查装置的气密性,②按要求连接制取装置,③向仪器①中注入稀盐酸,④收集气体,⑤向锥形瓶内放入石灰石,其正确的操作顺序是_____(填序号)。
(3)关闭K1和K3,打开K2,可用于验证二氧化碳的性质,若C中盛有澄清石灰水,则该反应的化学方程式为_____。若在C中盛有_____溶液,可以证明二氧化碳与水的反应,其反应方程式为_____。
(4)关闭K1和K2,打开K3,用该装置制取并收集一定体积的CO2,需要在D中液面上放一层植物油,其目的是_____。
【答案】长颈漏斗 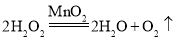 b ②①⑤③④ Ca(OH)2+CO2=CaCO3↓+H2O 紫色石蕊 H2O+CO2=H2CO3 防止二氧化碳溶于水
b ②①⑤③④ Ca(OH)2+CO2=CaCO3↓+H2O 紫色石蕊 H2O+CO2=H2CO3 防止二氧化碳溶于水
【解析】
(1)据图可知A装置中①仪器的名称是长颈漏斗;在装置A中没有酒精灯,可用于过氧化氢溶液在二氧化锰催化下生成水和氧气,反应的化学方程式为: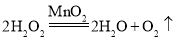 ;
;
(2)二氧化碳的密度比空气大,可用向上排空气法收集,用F装置收集,气体应该长进短出,则装置B应与F中的b端相连;实验室制取二氧化碳的正确步骤是:②①⑤③④;
(3)二氧化碳和氢氧化钙反应生成碳酸钙和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;在A中反应生成了二氧化碳,二氧化碳和水反应生成碳酸,酸能使紫色石蕊变红,二氧化碳和水反应成碳酸,化学方程式为:H2O+CO2=H2CO3;
(4)二氧化碳能溶于水,所以要在水的上方放一层植物油,故填:防止二氧化碳溶于水。

【题目】为测定某石灰石矿中碳酸钙的含量,兴趣小组同学称取 12.5g 石灰石矿样品粉末于烧杯中,将 80g 稀盐酸 分四次加入,充分反应,测得实验数据如下表所示(杂质不溶于水,也不参与反应,生成的气体全部逸出):
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸 的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余 物的质量 (g) | 30.5 | 48.5 | 68.1 | 88.1 |
(1)第_______次加入稀盐酸,样品中的碳酸钙就完全反应,生成__________g 二氧化碳。
(2)该石灰石矿中碳酸钙的质量分数为多少_______?(写出计算过程?)
【题目】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
【提出问题】过氧化钠与人体呼出的哪些气体发生反应产生氧气?
【信息提示】
①人呼出的气体中主要成分是氮气、二氧化碳、水蒸气和未被利用的氧气等。
②二氧化碳能与氮氧化钠反应:CO2+2NaOH=Na2CO3+H2O。
③氮气不能和过氧化钠反应。
【提出猜想】
①过氧化钠能与人呼出的水蒸气反应生成氧气。
②过氧化钠与人体呼出的二氧化碳反应生成氧气。
【进行实验】
实验一:验证过氧化钠能和水蒸气反应生成氧气。(如图1)
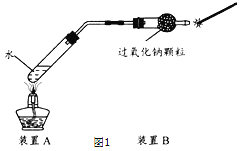
(1)小组成员按如图装置进行实验(夹持装置略)。
(2)其中装置A的作用是_____。将带火星木条放在装置B干燥管的右侧管口,观察到小木条复燃。
(3)实验结论:过氧化钠能和水蒸气反应生成氧气。请补充完整该反应的化学方程式:
2H2O+2Na2O2=_____+O2。
实验二:验证过氧化钠与二氧化碳反应生成氧气。(如图2)

同学们在老师的指导下,设计了上述装置进行实验(夹持装置略),并实验记录:
实验操作 | 主要实验现象 | 实验结论及解释 |
(1)检查装置的气密性 | ∕ | 装置气密性良好 |
(2)向装置A中加入大理石,打开分液漏斗上活塞,缓慢滴入稀盐酸 | 装置A中观察到的现象有_____;装置C装置中有气泡出现 | 装置A中发生反应的化学方程式为_____;装置C作用是_____ |
(3)一段时间后用带火星的木条在装置C的右侧导管口 | 带火星的木条复燃 | 过氧化钠与二氧化碳反应并生成氧气 |
【实验结论】过氧化钠能与人体呼出的水蒸气、二氧化碳分别反应生成氧气。
【实验反思】
某同学对实验二的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是_____。