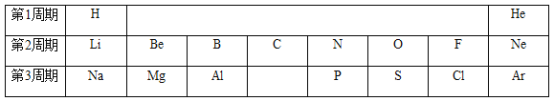
题目内容
【题目】为测定某石灰石矿中碳酸钙的含量,兴趣小组同学称取 12.5g 石灰石矿样品粉末于烧杯中,将 80g 稀盐酸 分四次加入,充分反应,测得实验数据如下表所示(杂质不溶于水,也不参与反应,生成的气体全部逸出):
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸 的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余 物的质量 (g) | 30.5 | 48.5 | 68.1 | 88.1 |
(1)第_______次加入稀盐酸,样品中的碳酸钙就完全反应,生成__________g 二氧化碳。
(2)该石灰石矿中碳酸钙的质量分数为多少_______?(写出计算过程?)
【答案】三 4.4 80%
【解析】
(1)第三次加入稀盐酸,样品中的碳酸钙就完全反应,因为第四次加入稀盐酸时,剩余物质量相对第三次增加了20g,刚好为所加稀盐酸的质量,生成的二氧化碳质量为12.5g+20 g +20 g +20 g -68.1 g =4.4g。
(2)设该石灰石矿中碳酸钙的质量为x,则
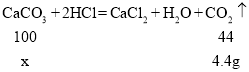
![]()
解得x=10g;
故该石灰石矿中碳酸钙的质量分数为![]() 。
。

【题目】小明把“探究鱼鳔内气体的体积和成分”作为研究性学习的课题。小明通过查阅资料获知:①这种鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气。②二氧化碳能溶于水。探究分两步进行。
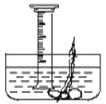
(1)测量鱼鳔内气体的体积。
方法A:用医用注射器取鱼鳔内气体,测量其体积;
方法B:如图所示,在水下刺破鱼鳔,用量筒采取排水法收集鱼鳔内气体并测量体积;你认为测量结果不准确的一种方法是______,理由是______
(2)探究鱼鳔内气体的成分。(现有两瓶鱼鳔内的气体)
步骤 | 操作 | 现象 |
验证鳔内含有氧气 | ______ | ______ |
验证鳔内含有二氧化碳 | ______ | ______ |
【题目】小明发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气的浓度最低值是多少呢?小明对此展开探究:第一组实验:取5支集气瓶,编号为① ② ③ ④ ⑤,分别装入其总容积10%、20%、30%、40%、50%的水.用排水法收集氧气恰好把5只瓶子中的水排去,将带火星的木条依次插入①~⑤号瓶中,记录实验现象.小明在前一组实验的基础上又做了第二组实验和第三组实验,三组实验的数据几现象如下:
第一组 | 第二组 | 第三组 | |||||||||
集气瓶号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
收集的氧气占容积的体积分数 | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
带火星的木条的状况 | 微 亮 | 亮 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 | ||
请根据实验回答下列问题:
(1)根据数据分析可得,收集的氧气占容积的体积分数最低为____%时可使带火星的木条复燃。
(2)第一组第⑤次氧气的体积分数是____?(答题卡上写出计算过程,结果保留整数).
【题目】实验室常用下列装置制取气体,请你根据所学知识回答下列问题:
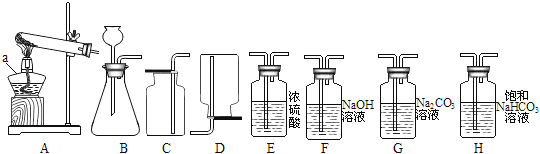
(1)仪器a的名称是_____。
(2)实验室用氯酸钾制取氧气时,选用的发生装置是_____(填字母序号)。若改用下图装置收集氧气,则气体应从______端进(填“a”或“b”)。
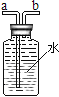
(3)实验小组同学取一定浓度的盐酸和石灰石反应制取气体,反应的化学方程式为____;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,小组同学讨论后作出如下猜想:
(作出猜想)A 石灰水已经完全变质 B 气体中有挥发出来的HCl气体
(实验探究)小组同学设计了如下实验来验证。请你帮助完成实验,填写以下表格:
实验步骤 | 实验现象 | 实验结论 |
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡 | ____ | 猜想A不成立 |
②将生成的气体通入_____溶液中 | 产生白色沉淀 | 气体中有HCl 猜想B成立 |
(查阅资料)碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+H2O+CO2=2NaHCO3
(拓展延伸)如果用上述原料制取一瓶干燥纯净的二氧化碳气体,所选仪器的连接顺序为B→(_____)→(_____)→C(填字母序号)。