题目内容
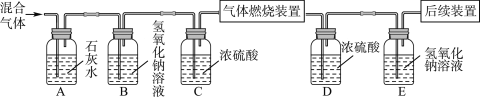
【题目】请根据下列装置,回答问题:
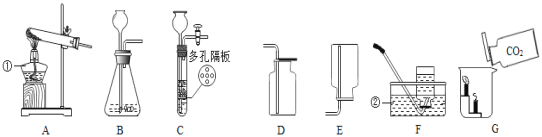
(1)标号①、②的仪器名称:①__,②__;
(2)实验室制取二氧化碳可以选择的发生装置是__(填写装置序号),写出用大理石和盐酸制取二氧化碳的化学方程式__;若要收集较干燥的二氧化碳,可选用的收集装置是__(填写装置序号)。
(3)在学习二氧化碳性质时,做了如图G所示的实验:向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭。说明二氧化碳气体具有的性质是__。
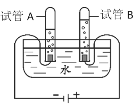
(4)实验室用稀硫酸与锌粒反应制取氢气时,装置B、C均可用作发生装置,相对于装置B来说,装置C具有__的优点,图中可供选用的收集装置有__(填序号)。
【答案】酒精灯 水槽 B或C CaCO3+2HCl=CaCl2+H2O+CO2↑ D 密度比空气大,不燃烧、也不支持燃烧 能够控制反应的开始与停止 E或F。
【解析】
本题为实验题,考查学生常见气体的实验室制取原理和对气体发生装置和收集装置的选择和应用。
(1)由图A可知标号①是酒精灯;
由图F可知标号②是水槽。
(2)由于实验室制取二氧化碳不需要加热,故发生装置选择B或C;
大理石和盐酸制取二氧化碳的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
因二氧化碳密度比空气大,且易溶于水,故收集二氧化碳只能用向上排空气法,选D。
(3) 向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭。说明二氧化碳气体具有的性质是密度比空气大,不燃烧、也不支持燃烧。
(4)因C装置比B装置导气管上多旋塞,反应容器中增加了多孔隔板,故装置C具有能够控制反应的开始与停止的优点;
因氢气密度比空气小,且难溶于水,所以,收集装置选向下排空气法或排水集气法,故选E或F。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】某同学为了测定实验室中氯酸钾样品中氯酸钾的质量分数。取15克该样品与5克二氧化锰混合。加热该混合物T1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热T2、T3、T4时间后剩余固体的质量,记录如下表。
加热时间 | T1 | T2 | T3 | T4 |
剩余固体质量(克) | 18.2 | 16.6 | 15.2 | 15.2 |
(1)完全反应后产生氧气的质量是____________ 。
(2)计算氯酸钾样品中氯酸钾的质量分数(要求书写计算过程,结果保留0.1%)___________。