题目内容
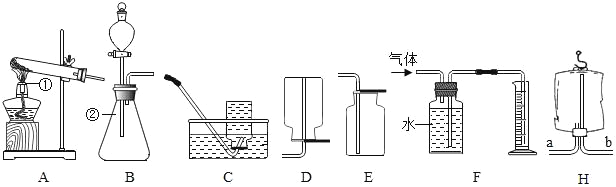
【题目】某校化学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样—个实验:让水蒸气通过一根烧红的枪管,生成了一种气体。同学们对这个实验很感兴趣:难道红热的铁能与水蒸气反应?生成的气体又是什么?带着这些疑问,他们设计了如图所示的装置(浓硫酸起吸收水分干燥气体的作用)进行探究。
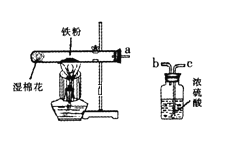
(1)已知湿棉花不参加化学反应,它的作用是_____。
(2)要干燥反应装置内生成出来的气体,则导管a应与___(选填“b”或“c”) 端导管口连接。
(3)对红热的铁(Fe)与水蒸气(H2O)反应生成的气体同学们有以下猜想:
猜想一:生成的气体可能是氢气; 猜想二:生成的气体可能是____。
(4)请你结合上述连接后的装置图,用一个简单的实验对猜想二生成的气体进行验证,并把实验的操作方法和现象填入下表。
操作方法 | 现象 | 结论 |
_______ | _______ | 猜想正确 |
【答案】提供水蒸气 C O2 将带火星的木条放在 b 管口 木条复燃
【解析】
(1)已知试管内湿棉花不参加化学反应,它的作用是提供水蒸气;
(2)若干燥从a导管出来的气体,应从c端管口通入;
(3)水和铁反应生成的气体不是氢气就是氧气,因为反应物中的元素有铁元素、氢元素和氧元素,这些元素组成的气体只有氢气和氧气;
(4)可以根据氧气能支持燃烧进行设计,方案如下:将带火星的木条放在b管口,木条复燃(或不复燃),生成的气体是氧气(或不是氧气)。

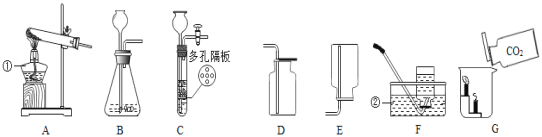
【题目】实验室可利用碱式碳酸铜(化学式:Cu2(OH)2CO3)制备氧化铜,并进行碳粉还原氧化铜的实验。
查阅资料:烧碱固体有吸水性且能与二氧化碳发生反应。
无水硫酸铜遇水会由白色变成蓝色。
①制备氧化铜并检验产物,装置如图所示(省略夹持仪器):
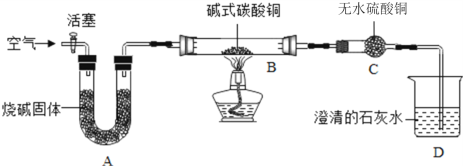
步骤一:连接A和B,打开活塞,通入空气。
步骤二:关闭活塞,连上C和D开始加热。观察到C中固体变蓝,D中澄清石灰水变浑浊。
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热。
加热时间(min) | 0 | t1 | t2 | t3 |
B中固体质量(g) | 6.66 | 5.20 | 4.80 | 4.80 |
①B中发生反应的化学方程式为:__________ , A的作用是吸收空气中的_______,防止对产物检验造成干扰。选择t3时停止加热的理由是____________。
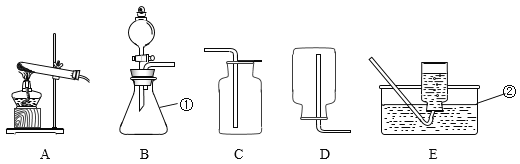
②一定量碳粉还原①中制得的氧化铜并检验产物,装置如图所示:写出该反应的化学方程式________,实验过程中,观察到F中溶液变浑浊,E中的现象是___________反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是____________
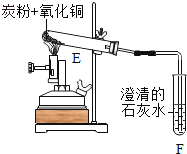
③若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因______________。
④计算②反应后理论上可制得多少克铜__________。