题目内容
【题目】下图是实验室制取气体常用的实验装置图,请回答下列问题:
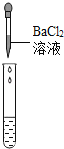
(1)写出装置图①中标号a的仪器名称_____;
(2)实验室常用过氧化氢溶液和二氧化锰混合制取氧气,用该方法制取并收集干燥的氧气应该选择的装置有_____(填序号);
(3)用排水法收集气体,导管口开始产生气泡不宜立即收集,当_____时,再把导管口伸入集气瓶。
【答案】长颈漏斗 ①③⑤ 导管口气泡均匀、连续冒出
【解析】
本题主要考察实验室制取氧气的相关知识
(1)a的仪器名称是长颈漏斗;
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,不需要加热,适合用装置A作发生装置,氧气的密度比空气大且不易溶于水,要收集氧气要用浓硫酸干燥并用向上排空气法收集,故应该选择的装置有:①③⑤;
(3)用排水法收集气体、导管口开始产生气泡不宜立即收集,当导管口气泡均匀、连续冒出时,再把导管口伸入集气瓶。

【题目】某学校化学兴趣小组的同学到化学实验室帮助老师准备酸、碱、盐性质的分组实验时,发现碱的药品柜中的一瓶氢氧化钠固体试剂瓶没有盖上瓶盖。小组同学征得老师的同意,决定对这瓶氢氧化钠固体进行探究。
(提出问题)这瓶氢氧化钠固体是否变质及变质的程度?
(查阅资料)
(1)氢氧化钠在空气中不仅吸收水分,还会与二氧化碳发生反应而变质,该反应的化学方程式为_____。
(2)BaCl2易溶于水,溶液呈中性;BaCO3是难溶于水的白色固体。
(猜想假设)
猜想一:没有变质
猜想二:部分变质
猜想三:_____
(设计实验方案)
为了提高同学们的动手操作能力和计算能力,老师要求同学们从定性和定量两方面来进行实验探究,下面是他们的探究方案,请你完成实验报告。
实验步骤 | 实验现象或结果 | 实验结论 |
①准确称量21.2g固体样品,平均分成两份,放到2个洁净的烧杯中加入适量水 | 全部溶解 | |
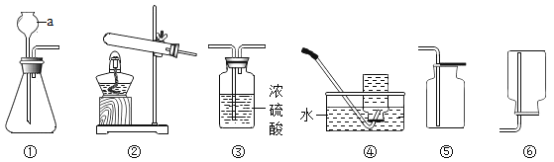
②向一烧杯中滴加足量的稀盐酸; | 有_____产生 | 猜想一不成立 |
③向另一烧杯中加入过量的BaCl2溶液,过滤、洗涤、干燥、称量。 | 得到19.7g白色沉淀 | 氢氧化钠固体已变质 |
(讨论交流)
(1)通过讨论同学们认为写出实验步骤③产生白色沉淀的化学反应是解答本题的关键,该反应的化学方程式为_____。
(2)通过利用以上数据计算,得出正确结论是猜想_____成立。
(3)同学们经过讨论认为在步骤③过滤后所得的滤液中,滴入酚酞溶液,溶液_____(填“不变色”或“变红色”),也能得出相同的结论。
(探究启示)我们做实验取完药品后,应_____。
【题目】小苏打(碳酸氢钠)在日常生活中有广泛的用途,工业上制取小苏打有多种方法,其中有一种是气相固碳法,其利用的原理是:![]()
资料:碳酸钠和碳酸氢钠的溶解度表(1个标准大气压下)(部分)
温度/℃ | 0 | 15 | 20 | 30 | 40 | 50 | 60 |
碳酸氢钠溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 | 12.7 | 14.45 | 16.4 |
碳酸钠溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
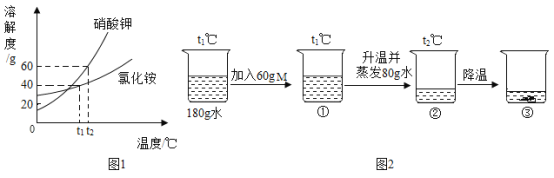
学校实验小组验证反应原理,在室温为15C时,同学们将10g氢氧化钠固体完全溶解溶于80g水中,而后缓慢且匀速地通入二氧化碳气体。同时用传感器测定溶液的pH变化,用数据采集器记录并绘制图象如图2所示。
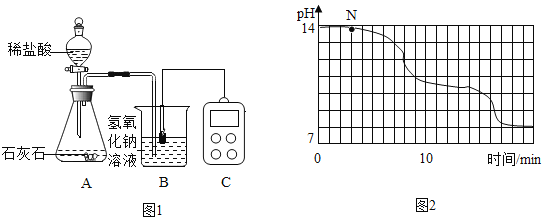
(1)图1中装置A的气密性检查方法是____________:该装置使用“分液漏斗”而不用“长颈漏斗”的原因是_____________
(2)通过图像分析,小苏打溶液显__________(填“酸性”、“中性”或“碱性”,图像中N点处发生的主要反应化学方程式为_____________。
(3)为了确定N处溶液的成分,同学们进行如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
步骤一 | 滴入_______ | 溶液变红 | N处溶液的成分有____ |
步骤二 | 加入_______ | _______ |
(4)实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时烧杯中可观察到的现象是______
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
(学生板演)该反应的化学方程式_____。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
(假设猜想)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:_____
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是_____,理由是_____。
(实验探究)
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有_____。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究。
实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | _____ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是_____;
②实验方案中也有一个是错误的,错误的原因是_____。
【题目】海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体。某化学兴趣小组在实验室中模拟该转化的过程如下:
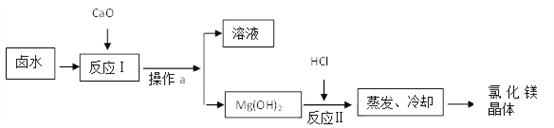
(1)“反应Ⅰ”中发生的反应有:CaO+H2O===Ca(OH)2,_____________。
(2)“操作a”的名称是__________。
(3)“反应Ⅱ”中发生反应的化学方程式为__________________;溶解5.8g Mg(OH)2需要36.5%HCl溶液___________g。
(4)为探究获得较高Mg(OH)2沉淀率的条件,该小组进行下列对比实验,数据如下:
实验编号 | MgCl2溶液浓度/g·L-1 | 反应温度/℃ | Mg(OH)2沉淀率/﹪ |
a | 20 | 30 | 27.06 |
b | 40 | 30 | 56.77 |
c | 40 | 40 | 69.64 |
d | 40 | 60 | 54.30 |
①实验b和c的目的是______________________________________________。
②由实验数据可知,能够得到最多Mg(OH)2的条件是氯化镁溶液浓度为______ g·L-1和反应温度为_________℃。