题目内容
【题目】某学校化学兴趣小组的同学到化学实验室帮助老师准备酸、碱、盐性质的分组实验时,发现碱的药品柜中的一瓶氢氧化钠固体试剂瓶没有盖上瓶盖。小组同学征得老师的同意,决定对这瓶氢氧化钠固体进行探究。
(提出问题)这瓶氢氧化钠固体是否变质及变质的程度?
(查阅资料)
(1)氢氧化钠在空气中不仅吸收水分,还会与二氧化碳发生反应而变质,该反应的化学方程式为_____。
(2)BaCl2易溶于水,溶液呈中性;BaCO3是难溶于水的白色固体。
(猜想假设)
猜想一:没有变质
猜想二:部分变质
猜想三:_____
(设计实验方案)
为了提高同学们的动手操作能力和计算能力,老师要求同学们从定性和定量两方面来进行实验探究,下面是他们的探究方案,请你完成实验报告。
实验步骤 | 实验现象或结果 | 实验结论 |
①准确称量21.2g固体样品,平均分成两份,放到2个洁净的烧杯中加入适量水 | 全部溶解 | |
②向一烧杯中滴加足量的稀盐酸; | 有_____产生 | 猜想一不成立 |
③向另一烧杯中加入过量的BaCl2溶液,过滤、洗涤、干燥、称量。 | 得到19.7g白色沉淀 | 氢氧化钠固体已变质 |
(讨论交流)
(1)通过讨论同学们认为写出实验步骤③产生白色沉淀的化学反应是解答本题的关键,该反应的化学方程式为_____。
(2)通过利用以上数据计算,得出正确结论是猜想_____成立。
(3)同学们经过讨论认为在步骤③过滤后所得的滤液中,滴入酚酞溶液,溶液_____(填“不变色”或“变红色”),也能得出相同的结论。
(探究启示)我们做实验取完药品后,应_____。
【答案】CO2+2NaOH═Na2CO3+H2O 完全变质 气体 Na2CO3+BaCl2=BaCO3↓+2NaCl 二 变红色 立即盖好瓶盖
【解析】
查阅资料:
(1)二氧化碳和氢氧化钠反应生成碳酸钠和水,该反应的化学方程式为CO2+2NaOH═Na2CO3+H2O;
猜想假设:
根据氢氧化钠变质的程度可知,猜想一:没有变质猜想二:部分变质猜想三:完全变质;设计实验方案:
碳酸钠和盐酸反应生成二氧化碳气体。猜想一不成立,说明氢氧化钠没有变质,氢氧化钠与盐酸反应明显的实验现象。向烧杯中滴加足量的稀盐酸,有气泡产生,猜想一不成立;
讨论交流:
(1)氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,该反应的化学方程式为Na2CO3+BaCl2=BaCO3↓+2NaCl;
(2)设:碳酸钠的质量为x。
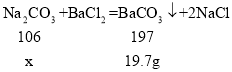
![]() x=10.6g
x=10.6g
21.2g>10.6g,所以含有氢氧化钠,得出正确结论是猜想二成立;
(3)氢氧化钠显碱性,能使酚酞试液变红,所以在步骤③过滤后所得的滤液中,滴入酚酞溶液,溶液变红色,也能得出相同的结论;
探究启示:
由于氢氧化钠易与空气中的二氧化碳反应,所以,实验取完药品后应立即盖好瓶盖。

 名校课堂系列答案
名校课堂系列答案【题目】做完“铁在氧气里燃烧”实验后,小冬同学有两个疑惑不解的问题,于是她进行了以下探究活动,请你一同参与。
【问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
【查阅资料1】
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧气氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液,如盐酸、硫酸等;
(3)铁能与硫酸铜溶液发生化学反应,但铁的氧化物不能与硫酸铜溶液反应;
(4)铁与酸的溶液反应(如盐酸、硫酸等),有气泡产生。
【实验探究】
将冷却后的黑色物质碾碎,装入试管,加入________溶液,观察到的现象是________,说明铁燃烧时溅落下来的黑色物质中还含有铁。
【问题2】铁燃烧的产物为什么不是Fe2O3呢?
【查阅资料2】
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | ﹣ |
熔点/℃ | ﹣ | ﹣ | 1535 |
(2)Fe2O3高温时分解成Fe3O4。
(3)Fe2O3的颜色为红棕色。
【理论探讨】
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在________之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是________。
【拓展延伸】实验中为了防止集气瓶炸裂,必须_______________;
(1)Fe2O3高温分解成Fe3O4和氧气,请写出此反应的化学方程式____________;
(2)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色________,就说明包装盒破损进气,这样售货员就能及时发现并处理。