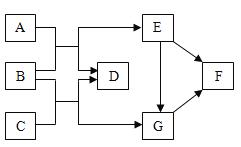
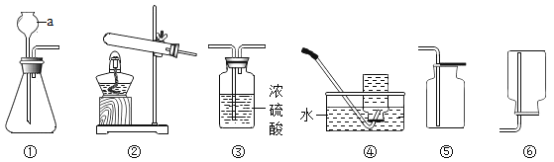
题目内容
【题目】海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体。某化学兴趣小组在实验室中模拟该转化的过程如下:
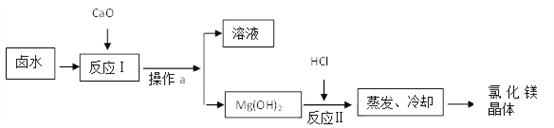
(1)“反应Ⅰ”中发生的反应有:CaO+H2O===Ca(OH)2,_____________。
(2)“操作a”的名称是__________。
(3)“反应Ⅱ”中发生反应的化学方程式为__________________;溶解5.8g Mg(OH)2需要36.5%HCl溶液___________g。
(4)为探究获得较高Mg(OH)2沉淀率的条件,该小组进行下列对比实验,数据如下:
实验编号 | MgCl2溶液浓度/g·L-1 | 反应温度/℃ | Mg(OH)2沉淀率/﹪ |
a | 20 | 30 | 27.06 |
b | 40 | 30 | 56.77 |
c | 40 | 40 | 69.64 |
d | 40 | 60 | 54.30 |
①实验b和c的目的是______________________________________________。
②由实验数据可知,能够得到最多Mg(OH)2的条件是氯化镁溶液浓度为______ g·L-1和反应温度为_________℃。
【答案】 Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓ 过滤 Mg(OH)2+2HCl==MgCl2+2H2O 20 探究MgCl2溶液浓度相同时,反应温度对Mg(OH)2沉淀率的影响 40 40
【解析】(1)根据“CaO+H2O=Ca(OH)2”,Ca(OH)2会与MgCl2反应生成氢氧化镁和氯化钙,反应的化学方程式为:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓;(2)此操作得到溶液和沉淀,可知操作为:过滤;(3) “反应Ⅱ”中发生反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;设需要36.5%HCl溶液的质量为x,
Mg(OH)2+2HCl==MgCl2+2H2O
58 73
5.8g x![]() 36.5%
36.5%
![]()
x=20g;
(4)①分析表中数据可知,实验b和c的目的是探究MgCl2溶液浓度相同时,反应温度对Mg(OH)2沉淀率的影响;②由实验数据可知,能够得到最多Mg(OH)2的条件是氯化镁溶液浓度为40g·L-1和反应温度为40℃。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】物质A、B、C、D、E分别是硫酸、氢氧化钠、氢氧化钡、碳酸钠、氯化锌五种溶液中的一种。已知C为氢氧化钠溶液,它们两两之间反应情况如下表所示:
反应物 | 反应现象 |
往C中加B | 溶液的pH变化趋势如图 |
往D中加B | 溶液中的溶质质量变化如图 |
B和E混合 | 产生大量的气泡 |
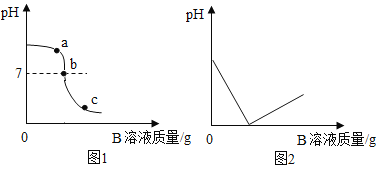
(1)A是__________溶液;E是__________溶液。
(2)图8中a点处溶液中所含溶质有____________________
(3)图9所示的反应原理为_________________(用化学方程式表示)。
(4)五种溶液两两之间混合后,可产生白色沉淀的反应原理共有__________个。