题目内容
【题目】(10分)“比较归纳法”是学习化学的一种重要方法。(“―”表示相连的两种物质能发生反应,“→”表示某种物质可通过一步反应转化为另一种物质。)
(1)请以表2中序号Ⅰ为示例,填写序号 Ⅱ、Ⅲ 中的空格:
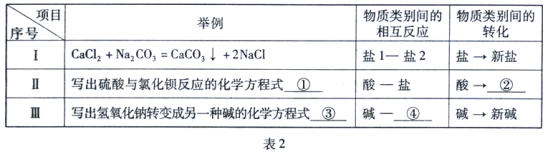
(2)室温下,氯化镁与下列物质的变化关系,正确的是____________(填标号)。
A.MgCl2 — AgNO3 B.KNO3 — MgCl2
C.MgCl2 — HCl D.Mg(OH)2 — MgCl2
【答案】(1) ① H2SO4 + BaCl2 = 2HCl + BaSO4↓ ② 新酸 ③ CuSO4 + 2NaOH = CuSO4 + Cu(OH)2↓
④ 盐 (2) A
【解析】
试题分析:硫酸和氯化钡的反应为H2SO4 + BaCl2 = 2HCl + BaSO4↓过程中是酸和盐的反应产生新的的酸和新的盐;氢氧化钠可以和盐反应产生另一种碱和盐;比如CuSO4 + 2NaOH = CuSO4 + Cu(OH)2↓;KNO3 — MgCl2;MgCl2 — HCl; Mg(OH)2 — MgCl2这三种转化无法一步完成,因为不符合复分解反应的条件。

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案【题目】(6分)下表是NaCl和KNO3在不同温度时的溶解度,请根据相关信息回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)60℃时,在100 g水里溶解_________g KNO3时,溶液才可达到饱和状态。
(2)下图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
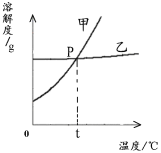
A.10℃~20℃之间 B.20℃~30℃之间
C.30℃~40℃之间 D.40℃~50℃之间
(3)请根据上表或图示总结出一条具有一定规律的结论 。
(4)在0℃时,分别在100 g 水中加入30 g NaCl 和KNO3固体,再加热到60℃时(假设溶剂不损耗),NaCl溶液为______(填“饱和”或“不饱和”)溶液。加热前后,有关两种溶液的说法正确的是_____(填字母序号)。
A.0℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数由小变大
D.加热前后,KNO3溶液中溶质的质量分数不变