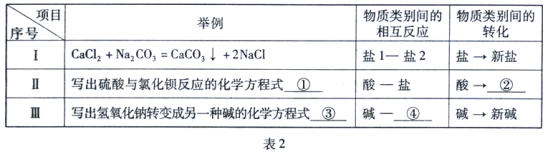
题目内容
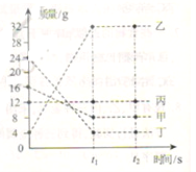
【题目】(5分)通过近一年的化学学习,你已经掌握了实验室制取气体的有关方法。请根据下图回答问题:
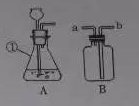
(1)仪器①的名称是 ,利用A装置可制取的气体有H2.O2和 。
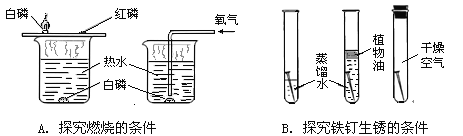
(2)B装置在化学实验中有广泛的用途。
①用排水法收集氢气,可在B装置中装满水后,使氢气从 口进入(填“a”或“b”)
②若要得到干燥的氢气,可在B装置中加入 ,气体应从 口进入(填“a”或“b”)
【答案】(1)锥形瓶;二氧化碳(2)①a ②浓硫酸;b
【解析】
试题分析:利用A装置可制取的气体有H2.O2和二氧化碳,这几个反应过程中都不需要加热;用排水法收集氢气,可在B装置中装满水后,使氢气从a端进,因为氢气的密度小于空气;若要得到干燥的氢气,可在B装置中加入浓硫酸;利用浓硫酸的吸水性,气体应从b端进入,充分和浓硫酸接触。

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目