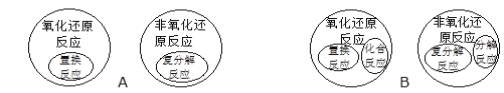
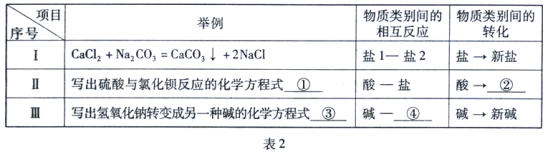
题目内容
【题目】(10分)分析处理图表中的信息是学习化学的一种重要方法。
(1)表3是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
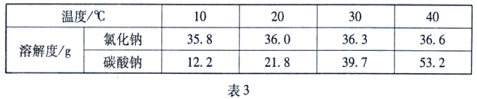
① 40℃时,氯化钠的溶解度为____________g。
②碳酸钠的溶解度随温度的升高而____________(填“增大”或“减小”)。在20℃时,
将100g的水加入30 g碳酸钠中,充分搅拌后得到的是____________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30度,该溶液的溶质质量分数为____________ (计算结果精确到0.1%)。
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是______。
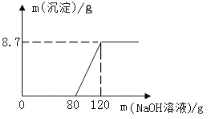
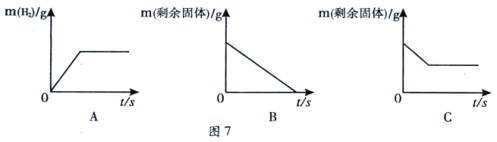
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式___________。图7是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是____________(填标号)。
【答案】(1)① 36.6 ② 增大 饱和溶液 23.1% ③ 碳酸钠饱和溶液
(2) Fe + 2HCl = FeCl2+H2↑ A C
【解析】
试题分析:从表格看40℃时,氯化钠的溶解度为36.6克;碳酸钠的溶解度随温度的升高而增大;将100g的水加入30 g碳酸钠中,充分搅拌后得到的是饱和溶液,因为此时碳酸钠的溶解度是21.8克,将上述溶液升温到30度溶解度变为39.7克,所以30克碳酸钠完全溶解,该溶液的溶质质量分数为=30克/130×100%= 23.1%;10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液,因为该温度时碳酸钠的溶解度小于氯化钠的溶解度;足量的稀盐酸加入一定量的铁、铜混合物中,其中能够反应的是铁和盐酸,其化学方程式为Fe + 2HCl = FeCl2+H2↑;A能够表示产生氢气的质量和时间的关系,因为开始后就会有气体产生,随着反应的进行气体质量不断的变大,但是当反应完后气体的质量就不会变化了;其中C能够表示固体的质量与时间的关系,银随着反应其中的铁会慢慢被反应掉,使得质量减少,但是最后铜不会反应,所以固体的质量不会变为零。