题目内容
要炼得56t含杂质3%的生铁,需要含Fe2O3 80%的赤铁矿多少吨?
97t
解析试题分析:已知:生铁的质量;未知:赤铁矿的质量
解题思路:铁矿石灰的主要成分是三氧化二铁,可与一氧化碳反应生成铁。(炼铁的原理)可利用三氧化二铁与铁在反应的化学 方程式中的质量关系进行求解。
解题过程:解:设需要含Fe2O3 80%的赤铁矿质量为x 设求知量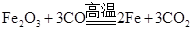
160 112
80%×x 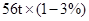
160/112=80%×x/56t×(1-3%)
x=97t
答:需要含Fe2O3 80%的赤铁矿97t。
也可利用铁元素的质量在反应过程中守恒来求解。
解题过程:需要铁矿石的质量为:56t×(1-3%)÷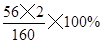 ÷80%=97t
÷80%=97t
考点:根据化学方程式的计算(根据化学式的计算)

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化成氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
现取该牛奶样品30 mL,用“盖尔达法”分解其中的蛋白质,产生的氨气用9.5 g溶质质量分数为4.9%的稀硫酸恰好完全吸收。计算并回答下列问题:
(1)产生氨气的质量是多少克?(计算结果精确到0.01 g,下同)
(2)30 mL牛奶中含氮元素的质量是多少克?
(3)下图是该牛奶包装标签的部分内容。已知牛奶中的蛋白质含氮元素的质量分数为16%,请你通过计算确定,该牛奶样品中蛋白质的含量是否达到了包装标签所标示的蛋白质的质量标准。
| 配料:鲜牛奶 保质期:8个月 净含量:250 mL/盒 营养成分:(每100 mL) 钙≥0.11 g 脂肪≥3.30 g 蛋白质≥2.90 g |
“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
| | 甲 | 乙 | 丙 |
| 烧杯+稀盐酸质量 | 139g | 129g | 129g |
| 加入黄铜样品质量 | 20g | 24g | 20g |
| 充分反应后,烧杯+剩余物质质量 | 158.8g | 152.8g | 148.8g |
请回答下列问题:
(1) 同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 。
(2)计算黄铜样品中锌的质量分数。
