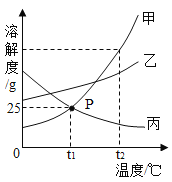
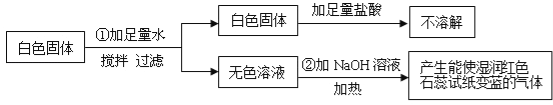
题目内容
【题目】化学兴趣小组对某品牌牙膏中碳酸钙的含量进行以下探究。
(查得资料)该牙膏摩擦剂主要由碳酸钙组成,其他成分遇到盐酸时无气体生成。
(进行实验)利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的沉淀质量,以确定碳酸钙的质量分数。
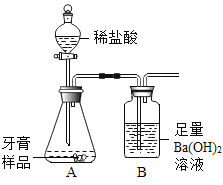
(1)写出B中反应的化学方程式__________________。
(2)准确称取8.00g样品三份,进行测量。待A中不再产生气体后停止滴加盐酸,将B中沉淀过滤,洗涤,干燥,测得沉淀平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(3)若过滤所得沉淀未经洗涤即干燥称量,测定结果偏大。请简述判断沉淀是否洗涤干净的方法________________。
(4)若计算值比实际值偏小,原因是_________________。
(5)小芳认为不必测定B中沉淀的质量,只要测定装置B在实验前后的质量差,一样可以确定碳酸钙的质量分数且操作更为简洁。你同意她的说法吗?为什么?_______________。
【答案】CO2 + Ba(OH)2 = BaCO3↓+ H2O 25% 取最后一次的洗涤液,向其中加入酚酞溶液,若酚酞不变色,则证明沉淀已经洗净 反应生成的CO2没有被Ba(OH)2溶液全部吸收(锥形瓶内有残留) 不同意。A中水蒸气、氯化氢气体等进入装置B中导致测定二氧化碳的质量偏大
【解析】
(1)A中盐酸与碳酸钙反应生成的二氧化碳与B中的氢氧化钡溶液反应生成碳酸钡的沉淀和水,反应的化学方程式为:CO2 + Ba(OH)2 = BaCO3↓+ H2O;
(2)设碳酸钙的质量为x。
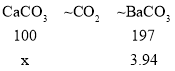
![]()
x=2g
样品中碳酸钙的质量分数为:![]() ×100%=25%
×100%=25%
(3)取最后一次的洗涤液,向其中加入酚酞溶液,若酚酞不变色,则证明沉淀已经洗净;
(4)若计算值比实际值偏小,原因是:反应生成的CO2没有被Ba(OH)2溶液全部吸收(锥形瓶内有二氧化碳残留);
(5)不同意。A中水蒸气、氯化氢气体等进入装置B中导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高。

【题目】日常生活中常采用煮沸方法将硬水软化。这种方法一定可靠吗?
(查阅资料)水的硬度由水中所溶解的可溶性钙镁化合物引起的,硬水中所溶解的钙镁化合物可分为两类:钙、镁的碳酸氢盐,如Ca(HCO3)2等;钙、镁的硫酸盐或氯化物,如CaCl2等,一般所说水的硬度是由上述两类化合物引起的。
(设计并实验)小明为方便研究准备了碳酸氢钙溶液和氯化钙溶液来代表两类不同的钙、镁化合物。
实验编号 | 实验操作 | 实验现象 |
① | 分别取5mL的碳酸氢钙溶液和氯化钙溶液于A. B两支试管中,同时加热 | A试管中产生大量气泡,有沉淀产生,B试管无明显现象 |
② | 在上述实验后,分别滴加4滴肥皂水,振荡 | A试管中有大量的泡沫,B试管中泡沫较少 |
(得出结论)
(1)煮沸实际上只能降低____________所引起的水的硬度。实验中A试管中碳酸氢钙分解除产生沉淀外,还生成了另外两种氧化物,请写出该反应的化学方程式_______________。
(评价与反思)
①小芳同学提出,若向碳酸氢钙溶液中滴加少量酚酞溶液,溶液变为红色,则说明__________________。
②在实验室中一般可通过___________来降低水的硬度,硬水会给我们的生活和生产带来很多危害,请写出一种___________________________________________________。
(实验拓展)向澄清石灰水中持续通CO2气体,会得到Ca(HCO3)2溶液。利用pH传感器测定在此操作过程中pH变化曲线如图所示:请写出两条现象或结论。
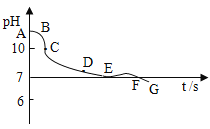
①______________________________________。
②______________________________________。