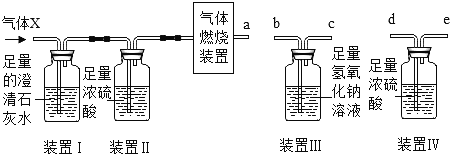
��Ŀ����
����Ŀ���ճ������г�������з�����Ӳˮ���������ַ���һ���ɿ���?
���������ϣ�ˮ��Ӳ����ˮ�����ܽ�Ŀ����Ը�þ�����������,Ӳˮ�����ܽ�ĸ�þ������ɷ�Ϊ���ࣺ�ơ�þ��̼�����Σ���Ca(HCO3)2�ȣ��ơ�þ�������λ��Ȼ����CaCl2�ȣ�һ����˵ˮ��Ӳ���������������������ġ�
����Ʋ�ʵ�飩С��Ϊ�����о�����̼�������Һ���Ȼ�����Һ���������ͬ�ĸơ�þ�����
ʵ���� | ʵ����� | ʵ������ |
�� | �ֱ�ȡ5mL��̼�������Һ���Ȼ�����Һ��A. B��֧�Թ���,ͬʱ���� | A�Թ��в�����������,�г�������,B�Թ����������� |
�� | ������ʵ���,�ֱ�μ�4�η���ˮ,�� | A�Թ����д�������ĭ,B�Թ�����ĭ���� |
���ó����ۣ�
(1)���ʵ����ֻ�ܽ���____________�������ˮ��Ӳ�ȡ�ʵ����A�Թ���̼����Ʒֽ�����������⣬�����������������������д���÷�Ӧ�Ļ�ѧ����ʽ_______________��
�������뷴˼��
��С��ͬѧ���������̼�������Һ�еμ�������̪��Һ����Һ��Ϊ��ɫ����˵��__________________��
����ʵ������һ���ͨ��___________������ˮ��Ӳ�ȣ�Ӳˮ������ǵ���������������ܶ�Σ������д��һ��___________________________________________________��
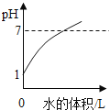
��ʵ����չ)�����ʯ��ˮ�г���ͨCO2���壬��õ�Ca��HCO3)2��Һ������pH�������ⶨ�ڴ˲���������pH�仯������ͼ��ʾ:��д�������������ۡ�
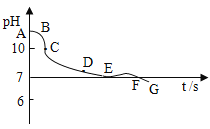
��______________________________________��
��______________________________________��
���𰸡��ơ�þ��̼�������� ![]() ̼����Ƶ�ˮ��Һ�ʼ��� ���� ��Ӳˮϴ������˷ѷ�����Ҳϴ�������� ���ʯ��ˮ����ǣ�֮������ó��� �������Ƶļ���ǿ��̼�����
̼����Ƶ�ˮ��Һ�ʼ��� ���� ��Ӳˮϴ������˷ѷ�����Ҳϴ�������� ���ʯ��ˮ����ǣ�֮������ó��� �������Ƶļ���ǿ��̼�����
��������
�ó����ۣ�
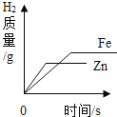
��1������������Ϣ��A�Թ����д�������ĭ��B�Թ�����ĭ���٣�˵�����Ⱥ�A�Թ���ˮ��Ӳ�Ƚ����ˣ���B�Թ���ˮ��Ӳ��û�н��ͣ�������ʵ����ֻ�ܽ��ơ�þ��̼���������������ˮ��Ӳ�ȣ�ʵ�����A�Թ���̼����Ʒֽ����������̼����⣬����������������������������غ㶨�ɷ�Ӧǰ��Ԫ������䣬��������������Ӧ��ˮ�Ͷ�����̼����˷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
�����뷴˼��
����̼�������Һ�еμ�������̪��Һ����Һ��Ϊ��ɫ����˵��̼����Ƶ�ˮ��Һ�ʼ��ԡ�
����ʵ���ҿ�������ķ���������ˮ��Ӳ�ȣ�Ӳˮ������ǵ���������������ܶ�Σ����������Ӳˮϴ������˷ѷ�����Ҳϴ�������
ʵ����չ��
��Ӳˮ��![]() ������Ȼ���е�
������Ȼ���е�![]() ��ˮ��
��ˮ��![]() �������·�Ӧ���ɵģ����ijͬѧ�����ʯ��ˮ�г���ͨ��
�������·�Ӧ���ɵģ����ijͬѧ�����ʯ��ˮ�г���ͨ��![]() ���壬�۲쵽�����������ʯ��ˮ����ǣ�֮������ó��塣
���壬�۲쵽�����������ʯ��ˮ����ǣ�֮������ó��塣
�ڸ���ͼʾ���Կ�������Һ��pH����С���ӽ�7�ģ����������Ƶļ���ǿ��̼����ơ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���ο�KNO3�IJ����ܽ�ȣ���������ͼʵ�������ÿ��������ܽ⣩������˵������ȷ����( )
�¶ȣ��棩 | 10 | 20 | 30 | 40 | 50 | 60 |
KNO3���ܽ�ȣ�g�� | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
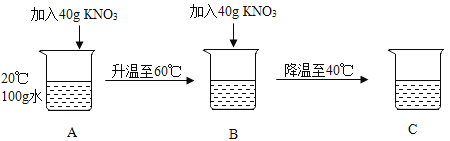
A.KNO3���ܽ�����¶ȱ仯Ӱ���
B.��ʵ�����������ֻ��A�DZ�����Һ
C.ʵ�����B��C�������о�������
D.ʵ�������������������������B
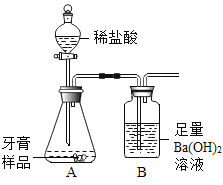
����Ŀ��ˮ�DZ������Ȼ��Դ������Ҫ��ʶ������������
(1)ˮ���ɣߣߣߣߣߣ���ɵģ����ˮ�Ļ�ѧ����ʽ�ǣߣߣߣߣߣߣߣ�
(2)Ӳˮ���������ǵ�������������ǿ����ãߣߣߣߵķ�����������
(3)���Ƽ����������н�Լ��ˮ��һ���þٴ�ߣߣߣߣߣ�
(4)��Ȼ���ˮ���ж������ʶ�����ֱ�����á���Ҫ��������ˮ��������������á�Ŀǰ�ܶ�����ˮ���������������������������г��ᷢ�����»�ѧ��Ӧ���䷴Ӧ���۹��̿�����ͼ��ʾ��

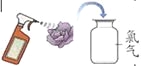
��D�Ļ�ѧʽΪHClO��д��ͼ����ʾ��Ӧ�Ļ�ѧ����ʽ ��С�������Ƶ�����ͨ����ɫʯ����Һ�У�����ط�����Һ�ȱ�죬���ž���ɫ�ˡ����������ϵ�֪���Ƶ���ˮ����Ư���ԡ�Ϊ̽����Һ��ɫ��ԭ��������˼���ʵ��:
��ʵ����������ɫʯ����Һ���ݼ���Сֽ���������ɣ������������Ƶ���ˮ����ȴ����������
ʵ���� | ʵ���� | ʵ���� | ʵ���� | ʵ���� |
|
|
|
|
|
��ʵ��������ʵ������_______________________ ��ʵ�����������ϻ�����ɫ
��ʵ�������ϻ��ȱ�����ɫ ��ʵ�������ϻ���죬����ɫ
��ʵ����ۣ�������ˮ�о���Ư���Ե�������______________��д��ѧʽ����