题目内容
【题目】有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KCl中的一种或几种.现做如下实验:
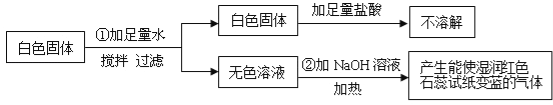
根据上述实验现象判断:
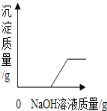
(1)白色固体中一定不含 ,一定含有 ,可能含有 .
(2)写出①中化学反应方程式 .
(3)写出②中化学反应方程式 .
【答案】(1)CuSO4、(NH4)2CO3; Na2SO4、BaCl2、NH4Cl; KCl
(2)Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)NaOH+NH4Cl![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
【解析】
试题(1)由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定没有碳酸铵,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有;故答案为:CuSO4、(NH4)2CO3; Na2SO4、BaCl2、NH4Cl; KCl
(2)硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和二氧化碳,故答案为:NaOH+NH4Cl![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O

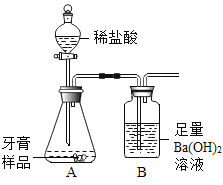
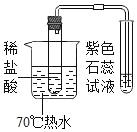
【题目】甲同学用如图所示装置制得CO2,并验证CO2能与水反应生成酸的性质。
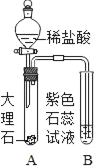
B试管发生的现象是_____,反应方程式是_____。
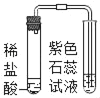
乙同学在实验时闻到制得的CO2有些刺激性气味,于是乙同学对气味的来源以及能使紫色石蕊溶液变红的酸性物质进行如下探究:
(查阅资料)大理石与稀盐酸反应产生热量;大理石无气味,稀盐酸有刺激性气味。
(提出猜想)刺激性气味来源于稀盐酸,并且混入与:
I.温度有关 II._____ III.温度及气流的速率有关
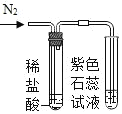
(进行实验)实验装置如下(三个实验中所用稀盐酸及紫色石蕊溶液的体积、溶质的质量分数均相同;夹持装置已略去)。
编号 | 实验装置及操作 | 实验现象与结论 |
1 |
| 一段时间内无现象。 |
2 |
| 紫色石蕊试液变红,_____成立。 |
3 |
| _____,猜想II成立。综上猜想III成立。 |
(拓展与思考)
(1)需在装置A、B之间增加装置C.装置C的作用是_____,装置C中药品应具有的性质是_____。
(2)将实验1的稀盐酸改为浓盐酸,紫色石蕊试液变红,说明浓盐酸具有的物理性质是_____。
(3)有同学认为实验1可以省去不做也可以验证猜想。你的观点是_____(填“能”或“不能”)验证猜想。