题目内容
【题目】人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明它们的化学性质_____;
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①比较两种铁矿石:磁铁矿(主要成分 Fe3O4)和菱铁矿(主要成分 FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是______;
②铝制品应用广泛,不易被腐蚀,是因为______(用化学方程式来表示);
(3)镁铝合金被誉为“21 世纪绿色金属结构材料”。一种镁铝合金 Mg17All2 是特殊的储氢材料,完全吸收氢气后得到 MgH2 和 Al,该反应的化学方程式为_____;
(4)钛和钛合金是 21 世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其_____(填字母序号)非常好;
A 可塑性 B 机械性能 C 抗腐蚀性能
(5)铁在潮湿的空气中易生成疏松的铁锈。已知:2FeCl3+Fe=3FeCl2
①铁锈的主要成分是________(填化学式),将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及______种化学反应基本类型;
②将 10g 表面生锈的铁钉(杂质已忽略)浸泡在 100g 溶质质量分数为 7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为 3.6g。则原生锈铁钉中铁元素的质量分数为______;
(6)利用“活泼金属”可以制得 H2 用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有________ (填字母序号)。
A 金属原料的成本 B 生成过程中的能耗和污染 C 金属的回收利用
【答案】稳定 磁铁矿含铁量高于菱铁矿 4Al+3O2=2Al2O3 Mg17All2+17H2=17MgH2+12Al C Fe2O3 3 92% ABC
【解析】
(1)金、银在自然界有单质形式存在,说明它们的化学性质都不活泼;
(2)①在Fe3O4中铁元素的质量分数=![]() ,在FeCO3中铁元素的质量分数=
,在FeCO3中铁元素的质量分数=![]() ,从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是磁铁矿含铁量高于菱铁矿;
,从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是磁铁矿含铁量高于菱铁矿;
②铝制品应用广泛,不易被腐蚀,是因为铝在空气易形成致密而坚实氧化铝氧化膜,阻止反应进一步进行,反应的化学方程式为:4Al+3O2=2Al2O3;
(3)该反应的反应物是Mg17Al12和H2,生成物是MgH2和Al,化学方程式为:Mg17All2+17H2=17MgH2+12Al;
(4)由于钛合金抗腐蚀性能非常好,所以钛合金制品放在海水中数年,取出后仍光亮如新,故选C;
(5)①铁锈的主要成分是Fe2O3;将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中发生的反应有:Fe2O3+6HCl=2FeCl3+3H2O,该反应是两种化合物相互交换成分生成两种化合物的反应,属于复分解反应;Fe + 2HCl = FeCl2 + H2↑,该反应是由一种单质与一种化合物生成另一种单质和另一种化合物的反应,属于置换反应:2FeCl3+Fe=3FeCl2,该反应是由两种物质生成一种化合物的反应,属于化合反应。变化过程中最多涉及三种化学反应基本类型;
②充分反应后都生成了FeCl2,根据质量守恒定律可知,FeCl2中的氯元素全部来自于盐酸,设FeCl2中铁元素的质量为x,则有:
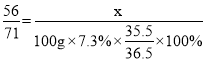 ,x=5.6;
,x=5.6;
原锈铁钉中铁元素的质量分数=![]() ;
;
(6)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有金属原料价格是否便宜、生成过程中的能耗和污染是否大、金属是否便于回收和利用等,故选ABC。

【题目】小兵和小东是某校化学研究性学习小组的成员,他们在查阅资料时,发现单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动。请你参与他们的这次活动,并解决有关问题。
(提出问题)木炭与氧化铜反应除生成单质铜外,另一种生成物是什么?
(猜想与假设)猜想一:可能是CO;猜想二:可能是CO2。
(设计实验方案)
(1)检验CO2的方法是__________(用化学方程式表示)。
(2)为了检验CO,他们设计的方案是:把小动物放在收集的气体中,观察能否存活。后经充分研究,认为此方案不能说明问题,其理由是____________
(查阅资料)他们在互联网上收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色。
(实验与结论)设计的实验装置图如下图所示,请完成下边的表格。
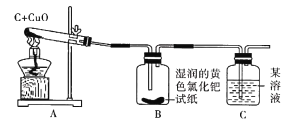
实验现象 | 实验结论 |
A中固体由黑色变成红色 | 有金属铜生成 |
B中黄色试纸没有变蓝 | 没有______生成 |
C中_________ | 有CO2生成 |
(反思与评价)如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是_____。
(注意:若答对第(3)小题奖励2分,化学试卷总分不超过40分。)
(3)对下列三种氧化铜和碳的质量比例,你建议选择_______(填序号)的比例。
A 38:3 B 40:3 C 42:3
你这样选择的理由是__________