题目内容
【题目】甲、乙、丙三种物质分别是高炉炼铁三种原料的主要成分,A~J 是初中化学常见的物质, 它们有如下转化关系(部分反应的生成物和反应条件已略去)。已知 B 在大气中的存在产生了温室应,H是通常状况下密度最小的气体,D 和 G 可以发生中和反应。

请回答下列问题:
(1)写出化学式: 甲______________, B______________;
(2)写出符合要求的化学方程式:
反应② ___________________,
反应③_____________________;
(3)在上述转化中,I 和 J 两种物质的组成元素相同,且反应⑤属于化合反应,则反应⑤的化学方程式为____________。
【答案】CaCO3 CO2 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 3C+2Fe2O3![]() 3CO2↑+4Fe Fe+2FeCl3═3FeCl2
3CO2↑+4Fe Fe+2FeCl3═3FeCl2
【解析】
B在大气中会产生温室效应,可以推出B是二氧化碳,H是通常状况下密度最小的气体,可知H是氢气,甲、乙、丙又是高炉炼铁的三种主要原料,可知甲、乙、丙应该是氧化铁、碳、石灰石中的一种,甲又会生成二氧化碳,所以甲就是碳酸钙,A就是氧化钙,氧化钙和水反应会生成氢氧化钙,所以C就是氢氧化钙,D和G会发生中和反应,D和二氧化碳反应又会生成E,所以D是一种碱,G是一种酸,D是氢氧化钠就满足要求,G是稀盐酸、稀硫酸都行,那么E就是碳酸钠,丙和酸会反应生成I,可以推出丙就是氧化铁,乙就是碳,F就是铁,铁和酸反应会生成氢气,氧化铁和酸反应生成的是铁盐,铁盐和铁反应会生成亚铁盐,再将推出的各种物质代入转化图中推导合理。
由分析可知(1) 甲是CaCO3, B是CO2;
(2)反应② 碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;反应③碳和氧化铁在高温的条件下生成铁和二氧化碳,反应方程式为:3C+2Fe2O3![]() 3CO2↑+4Fe;
3CO2↑+4Fe;
(3)铁和盐酸反应生成氯化亚铁和氢气,氧化铁和盐酸反应生成氯化铁,又知道F是铁,依据反应物和生成物可知,氯化铁和铁反应生成氯化亚铁,反应方程式为:Fe+2FeCl3═3FeCl2。

【题目】请从 A 或B 两题中任选一个作答,若两题均作答,按 A 计分。
在一定条件下,Mg 和 MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
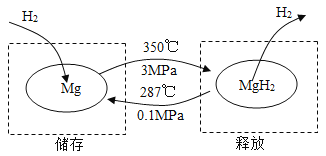
A | B |
(1)氢气储存时发生反应的化学方程式为_______。 (2)氢气很容易逃逸,若氢气存储效率为 10%,储存 1 kg 氢气,至少需要 Mg 的质量为_______ kg。 | (1)氢气释放时发生反应的化学方程式 为_______。 (2)理论上,52 kg MgH2最多能释放氢气的质量为_______ kg。 |