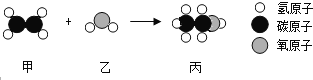
题目内容
【题目】向200gAgNO3溶液中加入m克Fe和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得21.6g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是( )
A.滤液的质量是178.4g
B.混合粉末的质量范围是5.6g<m<6.4g
C.固体中加入稀盐酸可能会有气体生成
D.原AgNO3溶液的溶质质量分数是17%
【答案】B
【解析】
加入氯化钠溶液后,产生白色沉淀,说明溶液中硝酸银有剩余,铁和铜全部被消耗完毕,而铁的金属活动性强于铜,所以是铁先与硝酸银反应,然后铜再与硝酸银反应。
A、根据分析可知,生成的固体全部为银,所以反应前质量为200g+mg,反应后质量=滤液质量+固体银的质量,所以滤液质量=200g+mg-固体银的质量=200g+mg-21.6g=178.4g+mg,所以滤液质量大于178.4g,选项A错误;
B、假设混合粉末中全是铁,则铁的质量为x,
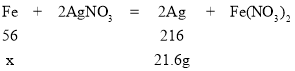
![]() ,x=5.6g
,x=5.6g
若混合物全是铜,则铜的质量为y,
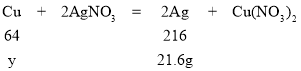
![]() ,y=6.4g
,y=6.4g
而混合物为铁和铜的混合物,所以其质量介于x与y之间,即5.6g<m<6.4g,选项B正确;
C、根据分析可知,铁被全部反应完毕,剩余的固体为生成的银,银金属活动性弱于氢,所以不会与酸反应生成氢气,选项C错误;
D、反应中铜和铁被全部消耗完毕,与硝酸银反应生成了银单质,而加入氯化钠之后,还有白色沉淀生成,说明还有硝酸银未反应,而先按生成21.6g银计算,根据银质量守恒,设硝酸银质量为a,a×![]() ,a=34g,溶质质量分数=
,a=34g,溶质质量分数=![]() ,而硝酸银还有剩余,所以含有硝酸银的质量大于34g,因此硝酸银溶液中溶质质量分数大于17%,选项D错误。故选B。
,而硝酸银还有剩余,所以含有硝酸银的质量大于34g,因此硝酸银溶液中溶质质量分数大于17%,选项D错误。故选B。

 名校课堂系列答案
名校课堂系列答案【题目】向氢氧化钠溶液中通入二氧化碳,反应的化学方程式为________,实验没有明显现象,若要证明两者发生了化学反应,你采取的实验方法是_______。
(1)但某同学在常温下向饱和的氢氧化钠溶液中通入二氧化碳时,发现溶液中出现了白色沉淀。同学们对此现象产生了浓厚的兴趣,准备对产生此现象的原因进行探究。
(查阅资料)①常温下部分物质的溶解度
物质名称 | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 |
溶解度(单位:g) | 109 | 21.5 | 9.6 |
②在碳酸钠溶液中不断通入二氧化碳可发生如下反应:Na2CO3+CO2+H2O=2NaHCO3
③碳酸氢钠溶液显碱性。
(提出问题)产生的白色沉淀是什么?
(提出猜想1)猜想①:可能是碳酸钠;猜想②:可能是碳酸氢钠;猜想③:可能是________
(设计实验1)小明向白色沉淀中加入大量水溶解得到溶液。向溶液中加入过量氯化钡溶液,观察到_____,过滤,向滤液中加入________,观察到溶液变为红色,得出结论猜想③成立。
(进一步探究)在氢氧化钠溶液中通入二氧化碳产生沉淀物与什么因素有关?
(提出猜想2)猜想①:可能与氢氧化钠溶液的浓度有关;猜想②:可能与通入的CO2气体量的多少有关。
(设计实验2)
(2)请帮助小明设计实验验证猜想①是否成立。
你的实验方案是:________
实验现象:________
实验结论:与NaOH溶液的浓度有关。
(3)进一步实验发现与通入的CO2气体量的多少也有关,最终得出猜想②也成立。
(拓展提升)向饱和的碳酸钠溶液中通入CO2气体,也有白色沉淀生成。
(4)分析生成沉淀的原因______,根据实验结论,写出一种鉴别饱和碳酸钠和碳酸氢钠溶液的方法____
(5)实验发现常温下,在一定溶质质量分数的碳酸钠溶液中通入足量的二氧化碳就能出现沉淀现象,该碳酸钠溶液的溶质质量分数应高于______(计算结果精确到0.1%)。
【题目】探究实验发现规律
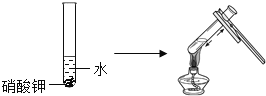
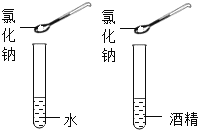
(1)探究影响物质溶解性的因素.
实验一 | 实验二 |
|
|
实验一目的是探究__________对硝酸钾溶解性的影响; 实验二观察到的实验现象为氯化钠溶解于水,不能溶解于酒精中。该实验的目的是探究__________对氯化钠溶解性的影响.
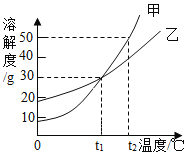
(2)运用溶解度曲线信息回答下列问题:甲、乙、丙三种物质(均不含结晶水)的如图所示,

①20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为__________。
②在__________时,甲和乙两物质的溶解度相等。若丙中混有少量甲,可将其溶液__________结晶,趁 热过滤以提纯丙。
③50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至 10℃,所得溶液中溶质质量分数最小的是__________。