题目内容
(8分)小强同学从旅游云南大理矿区取回了若干块矿石样品。
(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸)。
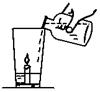
他能观察到的现象有:① ②
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
①8 g的石灰石样品中含有杂质 克;
②样品中碳酸钙的质量分数是 ;
③上表中m的数值应为 ;
④老师的问题:要得到3.3 kg的CO2,需要质量分数为80%的石灰石多少千克? 3分
(1)玲玲同学拿了一块在家做实验(如图所示),杯底放一支小蜡烛和样品粉末,沿杯壁缓缓倒入一定量的醋(含有3%~5%的醋酸)。

他能观察到的现象有:① ②
(2)在老师的指导下对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | m |
| 第3次 | 10 | 1.2 |
| 第4次 | 10 | 1.2 |
②样品中碳酸钙的质量分数是 ;
③上表中m的数值应为 ;
④老师的问题:要得到3.3 kg的CO2,需要质量分数为80%的石灰石多少千克? 3分
(1)①有气泡产生 ②蜡烛熄灭
(2)①1.2 ②85% ③3 ④9.375Kg
(2)①1.2 ②85% ③3 ④9.375Kg
试题分析:(1)云南大理盛产大理石,大理石的主要成分为碳酸钙,碳酸钙能与醋酸反应生成二氧化碳,会观察到有气泡产生;二氧化碳不能燃烧,不支持燃烧,且密度比空气大,可观察到蜡烛会熄灭。
(2)①由表中数据可知,在第三次加入10g盐酸后,固体剩余物质量不再减少,说明剩余的1.2g固体是不与稀盐酸反应的杂质;
②样品中碳酸钙的质量分数=
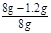 ×100%=85%;
×100%=85%;③由实验3可知,实验2中的碳酸钙有剩余,实验1中10g稀盐酸消耗碳酸钙(8g-5.5g=2.5g),同理实验2中的10g稀盐酸也消耗碳酸钙2.5g,故m=5.5g-(8g-5.5g)=3g;
④已知要得到3.3Kg的CO2,可根据化学方程式计算出所需碳酸钙的质量。
设需要质量分数为80%的石灰石的质量为x
CaCO3
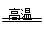 CaO+CO2↑
CaO+CO2↑100 44
80%×X 3.3Kg
100:44=80%×X :3.3Kg
解得X=9.375Kg
答:需要质量分数为80%的石灰石9.375Kg。
点评:根据化学方程式进行计算时,要注意所使用的质量必须都是纯净物的质量,不能把含杂质的物质的质量直接代入方程式进行计算。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
