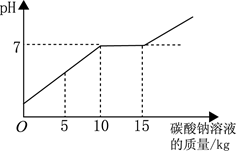
题目内容
取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水)。设该样品中的杂质既不与稀盐酸反应也不溶于水。试计算:(写出计算过程,计算结果保留一位小数)
(1)该反应中生成的气体的质量。
(2)参加反应的盐酸的质量。
(3)反应后所得溶液中溶质的质量分数。
(1)该反应中生成的气体的质量。
(2)参加反应的盐酸的质量。
(3)反应后所得溶液中溶质的质量分数。
(1)8.8 g (2)100 g (3)20%
试题分析:(1)可根据反应前后的质量差,运用差量法利用化学方程式求出反应的盐酸的溶质的质量,生成二氧化碳的质量及生成氯化钙的质量。
反应前后固体质量之差为27.2g-25g=2.2g
设反应生成二氧化碳的质量为X,生成氯化钙的质量为Y,参加反应的盐酸的溶质的质量为Z
CaCO3+2HCl═CaCl2+H2O+CO2↑ 反应前后固体的质量差
100 73 111 44 111-100=11
Z Y X 2.2g
73:Z =111:Y =44:X =11:2.2g
解之得:X=8.8g,Y=22.2g,Z=14.6g
答:生成气体的质量为8.8g
(2)参加反应的盐酸的质量为14.6g÷14.6%=100g
(3)反应后所的溶液为氯化钙溶液,反应后所得溶液的质量等于石灰石的质量和盐酸的质量减去杂质的质量和二氧化碳的质量之和,即溶液质量=25g+100g-(27.2g-22.2g)-8.8g=111.2g
所得溶液溶质的质量分数为
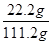 ×100%=20%
×100%=20%答:所得溶液溶质的质量分数为20%
点评:本题的一般解法是设杂质的质量为x,那么碳酸钙的质量和氯化钙的质量就可以用X表示,根据化学方程式列出二者的比例式解出X,进而逐步解答。快速解题的关键在于找出反应前后固体的质量差的化学意义,进而利用差量法进行快速解答。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 4NH3 + 3O2。计算生产136t NH3所需N2的质量。
4NH3 + 3O2。计算生产136t NH3所需N2的质量。
 Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?
Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?