题目内容
(3分)工业生产的纯碱产品中常含有少量的氯化钠(其它杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取12g样品放在烧杯中并滴入稀盐酸。当稀盐酸滴加至71g时,恰好完全反应,烧杯内溶液的总质量为78.6g(假设产生的气体全部逸出)。请计算:
(1)生成CO2的质量为____。
(2)样品中碳酸钠的质量分数。
(3)若将所得溶液配制成10%的NaCl溶液需要加水的质量。
(1)生成CO2的质量为____。
(2)样品中碳酸钠的质量分数。
(3)若将所得溶液配制成10%的NaCl溶液需要加水的质量。
(1)4.4g
(2)
(3)52.4g。
(2)

(3)52.4g。
试题分析:(1)由题意得,反应前后,物质的总质量减少的量为反应产生的二氧化碳的质量,二氧化碳质量为12g+71g-78.6g=4.4g。
(2)[解]设:样品中Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3 + 2HCl ====" 2NaCl" + H2O + CO2↑
106 117 44
x y 4.4g
 x = 10.6g
x = 10.6g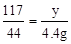 y = 11.7g
y = 11.7g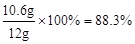
答:样品中碳酸钠的质量分数
 。
。(3)反应后,溶液中的溶质为氯化钠,其质量为12g-106g+11.7g=13.1g;
设:若将所得溶液配制成10%的NaCl溶液需要加水的质量为m克。
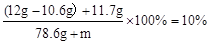
m = 52.4g
答:需要加水的质量为52.4g。
点评:本题有两个关键点,一是要根据数据分析得出二氧化碳的质量;二是分析得出最后溶液中溶质的质量;根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

练习册系列答案
相关题目
 4NH3 + 3O2。计算生产136t NH3所需N2的质量。
4NH3 + 3O2。计算生产136t NH3所需N2的质量。
 Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?
Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?