题目内容
(7分)将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g。求:(1)生成氧气多少克? (2)原氯酸钾的质量是多少克?
(1)9.6克 (2)24.5克
试题分析:根据质量守恒定律进行分析.根据氯酸钾分解的化学方程式可知,残渣是氯化钾和二氧化锰的混合物,由二氧化锰的质量可以计算出生成氯化钾的质量,由氯化钾的质量再根据上述反应就可以计算出生成氧气的质量.
解:由题意可知,残渣是氯化钾和二氧化锰的混合物,则氯化钾的质量为15.4g-0.5g=14.9g
设氧气的质量为x,原氯酸钾的质量为y,
2KClO3
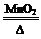 2KCl+3 O2
2KCl+3 O2 ↑
↑245 149 96
y 14.9g x
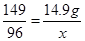
解得:x=9.6g
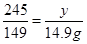
解得y=24.5g
答:生成9.6g氧气,原有氯酸钾24.5克。
点评:本题主要考查有关化学方程式的计算,解题时要注意残渣中含有催化剂二氧化锰.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 4NH3 + 3O2。计算生产136t NH3所需N2的质量。
4NH3 + 3O2。计算生产136t NH3所需N2的质量。