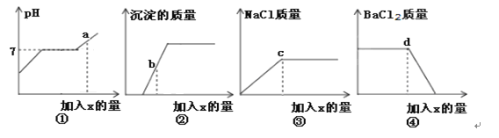
题目内容
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。CuCl 制备流程如下:
已知:CuCl 难溶于水和乙醇,在潮湿空气中易变质。
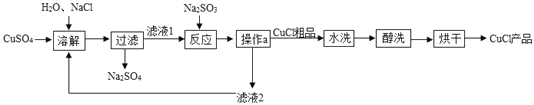
(1)“反应”中发生的化学变化是2CuCl2+ Na2SO3= 2CuCl↓+ 2NaCl + SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为________。
(2)“操作 a”的名称是_________。本流程中可以循环利用的物质(水除外)是_________填化学式)。
(3)可用“水洗”的原因是_________,检验水洗是否干净可选用试剂为________(填化 学式)溶液。“醇洗”的目的是_________。
(4)160g CuSO4与足量 NaCl 经上述制备流程,可生成的 CuCl 最多是_________g。
【答案】 SO3 + H2O = H2SO4 过滤 NaCl CuCl难溶于水 AgNO3 快速去除CuCl表面的水分,防止其变质 99.5
【解析】(1)产生的SO3迅速与水化合生成硫酸,该反应的化学方程式为:SO3+H2O═H2SO4;
(3)“操作a”的名称是过滤,通过过滤把液体和固体分离;“反应”中发生的化学变化是 2CuCl2 + Na2SO3 = 2CuCl↓+ 2NaCl + SO3,本流程中可以循环利用的物质(水除外)是NaCl;
(4)CuCl难溶于水,可用“水洗”的原因是能够除去可溶性杂质,水洗主要是除去氯化钠,可以用AgNO3溶液检测水洗是否干净;“醇洗”的目的是可以除去水,防止在后续步骤中CuCl变质;
(5)160gCuSO4中铜元素质量为:160g×![]() ×100%=64g,因为硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多是:64g÷(
×100%=64g,因为硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多是:64g÷(![]() ×100%)=99.5g。
×100%)=99.5g。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案