题目内容
【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂,下面是对硫酸的组成、性质、制取、用途等方面的探究,请你共同参与并回答有关问题
探究一、检测硫酸溶液中所含的离子
以下试剂能用来检测硫酸溶液中所含的阴阳离子的组合是____________(填序号)
①石蕊试液 氯化钡溶液 ②PH试纸、硝酸钡溶液 ③石蕊试液 稀盐酸、氯化钡溶液 ④硝酸钡溶液、稀硝酸 ⑤氯化钡溶液稀硝酸
探究二、硫酸的性质
由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异:
(1)探究浓硫酸的某些特征作了如下一些实验:
①用小木棍蘸取少量浓硫酸,放置一会后,可观察到________________
②兴趣小组把98%的浓硫酸10ml和63.3%的硫酸溶液(用10ml98%的浓硫酸与10ml水配成)约20ml分别放入两个相同的小烧杯中,称量、观察、记录、分析;根据室温环境下实验的数据绘成的曲线如图1;
由如图1曲线你能得到的实验结论有哪些?(写两点)_________________________
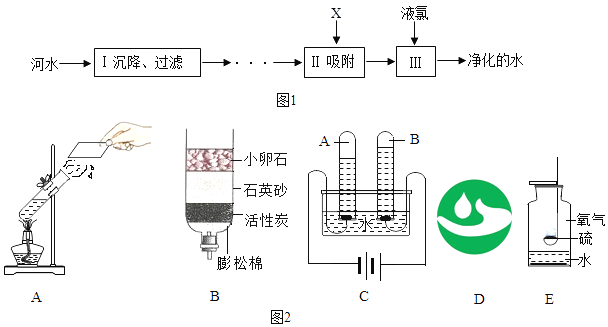
(2)浓硫酸的稀释;实验室用98%的浓硫酸(密度1.84g/cm3)配制100g溶质质量分数为20%的稀硫酸,需要水的体积为__________ml(精确到0.1);浓硫酸稀释过程如图2所示,b中盛放的物质是__________(填物质名称),a的作用是______________。
(3)探究稀硫酸的化学性质;
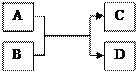
如图选择不同类别的物质与稀硫酸反应发生了如下颜色变化;
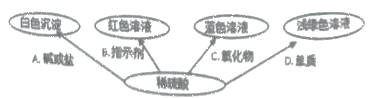
①请在编号C处填一种物质,则C是________________________________(写化学式)
②请写出B体现了稀硫酸的性质是__________________
③请写出符合编号A的一个化学反应方程式__________________
探究三、硫酸的工业制法
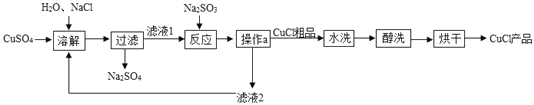
工业上黄铁矿为原料生产硫酸的工艺流程如图所示;
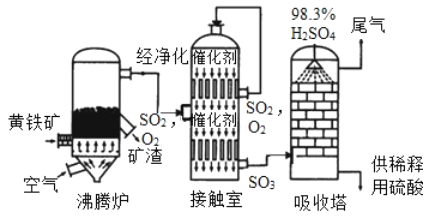
(1)接触室中发生的化学方程式为____________________________________________________ 硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途_____________________
(2)依据生产硫酸的工艺流程图,下列说法正确的是_____________填字母序号)
为使黄铁矿充分燃烧,需将其粉碎
催化剂能够提高SO2的反应速率和产量
吸收塔中得到的产品为混合物
沸腾炉排除的矿渣可供炼铁
(3)探究某黄铁矿中FeSO2的含量:
同学们进行了如下实验探究(假设每步反应均完全)。
【查阅资料】
①4FeS2+11O2![]() 2Fe2O3+8SO2 ②Na2SO3+H2O2=Na2SO4+H2O
2Fe2O3+8SO2 ②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
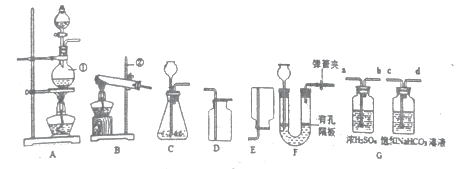
I称取1.60g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应。

II反应结束后,将乙瓶中的溶液进行如图处理
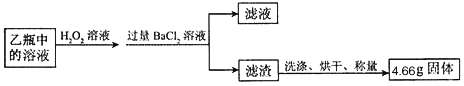
【问题讨论】
①I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是____________________;II中滤液所含的溶质一定有__________________________________。
【含量测定】
②II中最终得到的4.66g固体是_______填物质的化学式);
③计算该黄铁矿中FeS2的质量分数为______________;
【交流反思】
④如果缺少甲装置,则最终测得FeS2的质量分数将会__________________填“偏大”“偏小”“不变”
⑤如何证明II中所加BaCl2溶液已过量(请简要写出操作方法及现象_________________
【答案】 ③ 小木棍蘸取浓硫酸的部分变黑 浓硫酸比稀硫酸吸收能力强吸水速度快、吸水量大 ;浓硫酸和一定浓度以上的硫酸溶液都具有吸水性 79.6 浓硫酸 引流并不断搅拌 CuO 显酸性,能使石蕊试液变红 BaCL2+H2SO4=BaSO4![]() +2HCL 2SO2+O2
+2HCL 2SO2+O2![]() 2SO3 除铁锈 ACD 吸收空气中的二氧化碳 NaCl、BaCl2、NaOH BaSO4 75% 偏大 取滤液少量于试管中,滴加少量硫酸钠溶液,若有白色沉淀产生,则证明氯化钡已过量
2SO3 除铁锈 ACD 吸收空气中的二氧化碳 NaCl、BaCl2、NaOH BaSO4 75% 偏大 取滤液少量于试管中,滴加少量硫酸钠溶液,若有白色沉淀产生,则证明氯化钡已过量
【解析】探究一、检测硫酸溶液中所含的离子:检验某无色溶液是否为稀硫酸,先用紫色石蕊试液验证某无色溶液中含有氢离子,若变红,可确定该溶液显酸性;用盐酸酸化后能排除碳酸根离子的干扰,硫酸根离子与钡离子反应生成不溶于稀盐酸的白色沉淀硫酸钡,可用氯化钡溶液和稀盐酸来验证是否含硫酸根离子,故选③;
探究二、硫酸的性质:(1)①浓硫酸具有的脱水性。用小木棍蘸取少量浓硫酸,放置一会后,可观察到小木棍蘸取浓硫酸的部分变黑;
②从曲线观察两种不同的酸的吸水情况的变化可知: 浓硫酸比稀硫酸吸收能力强吸水速度快、吸水量大;浓硫酸和一定浓度以上的硫酸溶液都具有吸水性;
(2)(2)设需要浓硫酸的质量为x,100g×20%=x×98%,x=20.4g;配制时所需水的质量=100g-20.4g=79.6g,所需水的体积为79.6mL;稀释浓硫酸时,一定要将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并用玻璃棒搅拌。所以b中盛放的物质是浓硫酸,a的作用是引流并不断搅拌;
(3)探究稀硫酸的化学性质:(1)含有铜离子的溶液显蓝色,稀硫酸与氧化铜反应生成硫酸铜溶液与水,氧化铜属于氧化物,所以答案为:CuO;
(2)根据加入稀硫酸后,指示剂变红,说明是在稀硫酸中滴加石蕊,说明了硫酸显酸性,能使石蕊试液变红;
(3)因为硫酸可与氯化钡溶液或氢氧化钡溶液反应生成硫酸钡沉淀和对应的物质,与氯化钡反应的化学方程式是:BaCl2+H2SO4=BaSO4↓+2HCl,与氢氧化钡反应的化学方程式是:Ba(OH)2+H2SO4=BaSO4↓+2H2O;
探究三、硫酸的工业制法:(1)由图示可知,在接触室内,二氧化硫和氧气在加热和催化剂的条件下生成了三氧化硫,反应的方程式是:2SO2+O2![]() 2SO3;稀硫酸的用途有除锈等;
2SO3;稀硫酸的用途有除锈等;
(2)A、为使黄铁矿充分燃烧,需将其粉碎,能增大与氧气的接触面积,正确;B、催化剂能够提高SO2的反应速率,不能提高产量,错误;C、吸收塔中得到的产品为混合物,正确;D、沸腾炉排出的矿渣中含有氧化铁,可供炼铁,正确。故选ACD。
(3)探究某黄铁矿中FeSO2的含量:
①由于空气中的二氧化碳能与氢氧化钠反应影响二氧化硫的测定,Ⅰ中装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是吸收空气中的二氧化碳;由于过氧化氢具有强氧化性,能将乙瓶中亚硫酸钠氧化成硫酸钠,硫酸钠溶液与过量的BaCl2反应生成硫酸钡和氯化钠,过滤后得到的滤液中一定存在生成氯化钠和过量的氯化钡,氢氧化钠;
②II中最终得到的4.66g固体是BaSO4;
③由于在化学变化中硫元素质量守恒,所以硫元素的质量:4.66g×![]() ×100%=0.64g,FeS2的质量:0.64g÷(
×100%=0.64g,FeS2的质量:0.64g÷(![]() ×100%)=1.2g,
×100%)=1.2g,
黄铁矿中FeS2的质量分数=![]() ×100%=75%;
×100%=75%;
④如果缺少甲装置,由于二氧化碳能与氢氧化钠反应,则最终测得FeS2的质量分数将会偏大;
⑤若氯化钡过量则滤液中应存在氯化钡,由于硫酸钠能与氯化钡反应,Ⅱ中证明所加BaCl2溶液过量的方法是:取滤液少许于试管中,滴加氯化钡溶液,若有白色沉淀,则氯化钡过量。