题目内容
【题目】小明在实验室里围绕着“盐的性质”这一主题进行了如下的实验探究
甲 乙
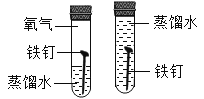
(1)甲实验中反应的化学方程式为_______;
(2)乙实验观察到的现象是_______。
(3)实验后,小明把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成,他决定对白色沉淀的成分进行探究(提示:本题中碳酸镁视为沉淀处理)
(提出猜想)白色沉淀为:猜想Ⅰ_______;
猜想Ⅱ:Mg(OH)2和BaSO4;猜想Ⅲ:Mg(OH)2和MgCO3;
猜想Ⅳ:Mg(OH)2、MgCO3和BaSO4
小红认为猜想Ⅳ一定不成立,其理由是_______。
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若_______,猜想Ⅰ成立;其化学反应方程式为_______。 ②若_______,猜想Ⅱ成立。 ③若_______,猜想Ⅲ成立。 |
(拓展与思考)
如果猜想Ⅲ成立,产生此结果的原因是做甲实验时_______。
【答案】Ba(OH)2+Na2CO3═BaCO3↓+2NaOH; 镁条表面出现红色固体,溶液由蓝色逐渐变为无色 猜想ⅠMg(OH)2 如果碳酸钠有剩余,则氢氧化钡不会有剩余,会生成氢氧化镁沉淀和碳酸镁沉淀,不会生成硫酸钡沉淀。 沉淀全部溶解,且无其它现象 Mg(OH)2+2HCl=MgCl2+2H2O 白色沉淀部分溶解且无气体产生 若沉淀完全溶解,且有气体产生 滴加的碳酸钠过量
【解析】
(1)甲实验中是:碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,故反应的化学方程式写为:Ba(OH)2+Na2CO3═BaCO3↓+2NaOH。
(2)金属活动性顺序,镁可以把铜从其盐溶液中置换出来,镁与硫酸铜反应,生成铜与硫酸镁,乙实验观察到的现象是:镁条表面出现红色固体,溶液由蓝色变成无色,故填镁条表面出现红色固体,溶液由蓝色逐渐变为无色。
{提出猜想}甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成,白色沉淀中一定有乙中生成的硫酸镁与甲中生成的氢氧化钠反应生成的氢氧化镁沉淀,故填猜想Ⅰ:Mg(OH)2;
如果甲中碳酸钠与氢氧化钡恰好完全反应,则硫酸镁与甲中的氢氧化钠反应,生成氢氧化镁沉淀,白色沉淀为:Ⅰ.Mg(OH)2;如果氢氧化钡有剩余,则白色沉淀为:Ⅱ.Mg(OH)2和BaSO4;如果碳酸钠有剩余,则白色沉淀为:Ⅲ.Mg(OH)2和MgCO3,由于甲反应后的溶液中碳酸钠与氢氧化钡不能共存,如果碳酸钠有剩余,则氢氧化钡不会有剩余,会生成氢氧化镁沉淀和碳酸镁沉淀,不会生成硫酸钡沉淀,所以猜想Ⅳ不成立,故填如果碳酸钠有剩余,则氢氧化钡不会有剩余,会生成氢氧化镁沉淀和碳酸镁沉淀,不会生成硫酸钡沉淀。
{实验方案}①如果猜想Ⅰ成立,则氢氧化镁与加入的盐酸反应生成可溶性的氯化镁和水,观察到的现象是沉淀全部溶解,且无其它现象,故填沉淀全部溶解,且无其它现象;
氢氧化镁与盐酸反应生成氯化镁和水,故反应的化学方程式写为:Mg(OH)2+2HCl=MgCl2+2H2O。
②若猜想Ⅱ成立,其中的氢氧化镁与盐酸反应生成可溶性的氯化镁和水,硫酸钡与盐酸不反应,观察到的现象是白色沉淀部分溶解,且无气体产生,故填白色沉淀部分溶解且无气体产生。
③若猜想Ⅲ成立,氢氧化镁与盐酸反应生成可溶性的氯化镁和水,碳酸镁与盐酸反应生成可溶性的氯化镁、水和二氧化碳,观察到的现象是沉淀完全溶解,且有气体产生,故填沉淀完全溶解,且有气体产生。
{拓展与思考}如果猜想Ⅲ成立,产生此结果的原因是做甲实验时滴加的碳酸钠过量,过量的碳酸钠与乙中的硫酸镁生成了碳酸镁,故填滴加的碳酸钠过量。

【题目】某班同学用氢氧化钠溶液和稀盐酸进行中和反应实验:
(1)甲同学实验操作如下:
在烧杯中加入约5 mL氢氧化钠溶液、滴入几滴无色酚酞溶液,此时溶液呈________色。接着用滴管滴入一定量的稀盐酸,再用玻璃棒____________,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为________________________。
(2)乙同学对甲同学的结论提出了质疑,并对反应后溶液中的溶质成分进行探究。
(实验探究)反应后溶液中的溶质是什么?
猜想一:只有NaCl
猜想二:NaCl和HCl
猜想三:NaCl和NaOH
以上猜想中,你觉得不合理的是________________。
为了验证另外两种猜想,乙同学设计如下实验方案。
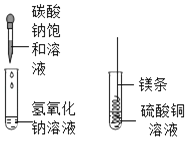
实验操作 | 实验现象 | 实验结论 |
取少量反应后的溶液于试管中滴入Na2CO3溶液 | ________ | 猜想二成立 |
(反思交流)实验结束后,废液处理方法正确的是______(填序号)。
A 倒入下水道 B 倒入废液缸 C 带出实验室
(拓展延伸)乙同学再设计一个验证猜想二的实验:取少量反应后的溶液于试管中加入少量氧化铜粉末,若________________________,猜想二成立。
(3)用溶质质量分数为5%的NaOH溶液完全中和73 g10%的稀盐酸,需NaOH溶液多少克________?
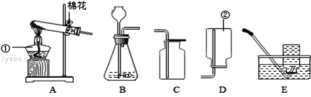
【题目】小明同学对家中久置的袋装固体食品防腐剂的成分产生了兴趣(品名和成分如图所示),于是和同学一起,设计实验进行探究:

[提出问题]久置固体食品防腐剂的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3 。
[实验探究]甲同学的探究方案如下表:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有_______和氢氧化钙。此过程的化学方程式_______。 |
(2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有Fe ,一定不含 Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | ________ | 固体中一定含有CaCO3 |
[交流与反思]
(1)“504双吸剂”中的铁粉可以吸收空气中的_______、______。
(2)实验操作(2)的实验现象里“有大量无色气体产生”, 根据甲同学的整体探究方案推测,无色气体的成分是一定含有______,可能含有________。
(3)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是______。
(4)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_______。