题目内容
【题目】物质甲、乙、丙的溶解度曲线如图所示。下列说法错误的是
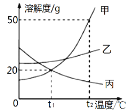
A. t1℃时,甲、丙饱和溶液的溶质质量分数都是16.7%
B. 使甲从溶液中结晶,只能用冷却热饱和溶液的方法
C. t2℃时150 g甲的饱和溶液降温到t1℃,能析出30g晶体
D. 将t2℃的三种物质饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系是乙>甲>丙
【答案】B
【解析】
A、根据溶解度曲线可知,t1℃时,甲、丙的溶解度都是20g,饱和溶液的溶质质量分数=![]() ,故A正确;
,故A正确;
B、甲的溶解度随温度的升高而增大,使甲从溶液中结晶,除了用冷却热饱和溶液的方法外,还可以用蒸发结晶的方法,故B错误;
C、由溶解度曲线可知,t2℃的甲的溶解度时候50g,t1℃的溶解度是20g,t2℃的150g甲的饱和溶液降温到t1℃,能析出30g晶体。故C正确;
D、将t2℃时甲、乙、丙三种物质的饱和溶液降温到t1℃时,甲、乙的溶解度减小,丙的溶解度随温度的降低而增大,甲、乙有晶体析出,质量分数变小溶液仍为饱和溶液,丙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质质量分数=![]() ,溶解度越大,质量分数越大,t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是乙>甲>丙。故D正确。故选B。
,溶解度越大,质量分数越大,t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是乙>甲>丙。故D正确。故选B。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】小明在实验室里围绕着“盐的性质”这一主题进行了如下的实验探究
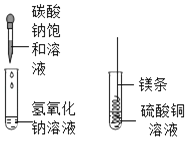
甲 乙
(1)甲实验中反应的化学方程式为_______;
(2)乙实验观察到的现象是_______。
(3)实验后,小明把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成,他决定对白色沉淀的成分进行探究(提示:本题中碳酸镁视为沉淀处理)
(提出猜想)白色沉淀为:猜想Ⅰ_______;
猜想Ⅱ:Mg(OH)2和BaSO4;猜想Ⅲ:Mg(OH)2和MgCO3;
猜想Ⅳ:Mg(OH)2、MgCO3和BaSO4
小红认为猜想Ⅳ一定不成立,其理由是_______。
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若_______,猜想Ⅰ成立;其化学反应方程式为_______。 ②若_______,猜想Ⅱ成立。 ③若_______,猜想Ⅲ成立。 |
(拓展与思考)
如果猜想Ⅲ成立,产生此结果的原因是做甲实验时_______。