题目内容
【题目】课堂上老师对探究干电池原理的实验进行如下改进,图甲:把一块锌片和一根碳棒同时插入盛有稀硫酸的U型管中;图乙:用导线将锌片和碳棒连接起来插入盛有稀硫酸的U型管中,并在导线中间连接一只灵敏电流计。
请按要求回答相关问题
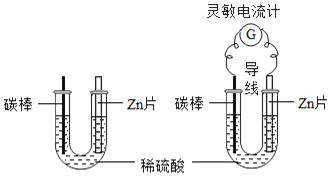
甲 乙
(1)图乙主要的能量转化形式是_______。
(2)乙观察到与甲不同的现象是_______。
(3)配制所需稀硫酸:现有98%的浓硫酸18g(体积为9.8mL),可将其配成24.5%的硫酸溶液_______g,配制的具体操作过程是_______(水的密度为1g/mL)
【答案】化学能转化成电能 碳棒上产生气泡 72; 量取54mL水倒入烧杯中,再量取9.8mL浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌。
【解析】
(1)图乙主要的能量转化形式是化学能转化成电能,故填化学能转化成电能。
(2)甲中锌片表面产生气泡,乙中电流表指针发生偏转,碳棒表面产生气泡,因此乙观察到与甲不同的现象是碳棒上产生气泡,故填碳棒上产生气泡。
(3)可将其配成24.5%的硫酸溶液质量为:98%×18g÷24.5%=72g,故填72;
需要水的质量为:72g﹣18g=54g,54g水的体积为:54g÷1g/mL=54mL,配制的具体操作过程是:量取54mL水倒入烧杯中,再量取9.8mL浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌,故填量取54mL水倒入烧杯中,再量取9.8mL浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
Ⅰ.探究铜锈的组成
(査阅资料)①铜锈受热易分解②硫酸铜粉末遇水由白色变为蓝色
(进行实验)小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
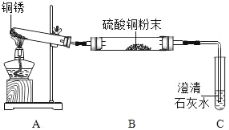
(解释与结论)(1)C中反应的化学方程式是_____。
(2)依据以上现象分析,铜锈中一定含有的元素:Cu和_____。
Ⅱ.探究铜生锈的条件
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如图所示的4个实验并持续观察。
编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 |
(讨论交流)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验②和③,得出的结论是_____。
(4)为验证猜想,请将实验④补充完整,广口瓶中填充物有铜丝和_____。
(获取结论)铜生锈的条件是_____。
(反思应用)
结合上述实验,你对保存铜制品的建议是_____。
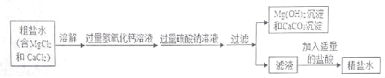
【题目】小明在实验室里围绕着“盐的性质”这一主题进行了如下的实验探究
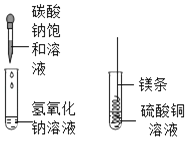
甲 乙
(1)甲实验中反应的化学方程式为_______;
(2)乙实验观察到的现象是_______。
(3)实验后,小明把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成,他决定对白色沉淀的成分进行探究(提示:本题中碳酸镁视为沉淀处理)
(提出猜想)白色沉淀为:猜想Ⅰ_______;
猜想Ⅱ:Mg(OH)2和BaSO4;猜想Ⅲ:Mg(OH)2和MgCO3;
猜想Ⅳ:Mg(OH)2、MgCO3和BaSO4
小红认为猜想Ⅳ一定不成立,其理由是_______。
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若_______,猜想Ⅰ成立;其化学反应方程式为_______。 ②若_______,猜想Ⅱ成立。 ③若_______,猜想Ⅲ成立。 |
(拓展与思考)
如果猜想Ⅲ成立,产生此结果的原因是做甲实验时_______。