题目内容
【题目】在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整. 取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象.
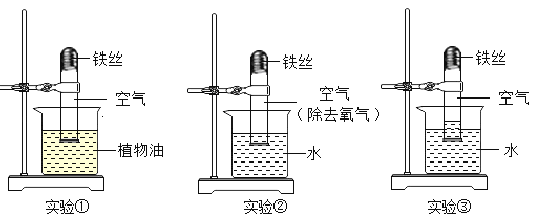
(1)实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小. 铁生锈实际上是铁与空气中的____(填物质名称)发生反应的结果.
(2)当铁丝足量,时间足够长,实验③进入试管的水的体积大约占试管体积的____.
(3)该小组的一位同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究,同学们对滤液所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:(以下填写溶质的化学式)
①溶质为____;②溶质为____。
(4)组内另一位同学设计了一个简单的实验方案探究Fe、Cu、Zn三种金属的活动性顺序,实验室仅使用了三种药品,请写出其所用的一组药品是__。
【答案】水和氧气 1/5 Zn(NO3)2、Cu(NO3)2 Zn(NO3)2、Cu(NO3)2和AgNO3 Zn、FeSO4、Cu
【解析】
(1)实验①中的铁丝只与含有氧气的空气接触,铁不生锈;实验②中的铁丝与水和没有氧气的空气接触,铁不生锈;实验③中铁丝同时与氧气和水接触,铁丝生锈,且试管内空气体积减小。证明铁生锈实际上是铁与空气中的水和氧气发生反应的结果。
(2)空气中氧气含量约占空气体积的1/5,实验③铁丝生锈消耗完试管内的氧气,则进入试管的水的体积大约占试管体积的1/5。
(3)将铜粉和锌粉的混合物放入一定量的硝酸银溶液中,因为这三种的金属活动性顺序由强到弱是锌、铜、银,所以反应顺序是锌先与硝酸银反应,锌反应完后,铜再与硝酸银反应。当充分反应后过滤,得到固体和蓝色滤液,说明溶液中一定含有硝酸铜,铜参与了反应,证明锌固体已反应完,则溶液中也一定含有硝酸锌,但无法证明硝酸银是否反应完,故对滤液所含的溶质做出两种猜想:①溶质为Zn(NO3)2、Cu(NO3)2;②溶质为Zn(NO3)2、Cu(NO3)2和AgNO3。
(4)设计一个简单的实验方案探究Fe、Cu、Zn三种金属的活动性顺序,仅用三种药品,该组药品可以是Zn、FeSO4溶液、Cu。锌放入硫酸亚铁溶液中,锌表面有银白色固体析出,则锌比铁活泼;铜放入硫酸亚铁溶液中,铜表面无明显现象,则铁比铜活泼。可以得出三种金属的活动性强弱顺序为Zn 、Fe、Cu。

【题目】四位同学元旦去礐石风景区游玩,带回了几小块石灰石样品。为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用浓度相同的盐酸与样品充分反应来进行实验测定,(样品中的杂质不溶于水,且不与盐酸反应)测定数据如下:
甲同学 | 乙同学 | 丙同学 | 丁同学 | |
所取石灰石样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量(g)烧杯中 | 10.0 | 20.0 | 30.0 | 40.0 |
剩余物质的总质量(g) | 19.0 | 28.0 | 37.0 | 46.7 |
试回答:
(1)四位同学里面,______同学的实验样品完全反应;10.0g石灰石样品与 _______g盐酸恰好完全反应。
(2)求样品中碳酸钙的质量分数为___________(写出计算过程)。
(3)请在图中画出加入稀盐酸的质量与生成气体的质量的变化关系(标注必要的数值)。
 ___________
___________
【题目】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将160g氯化钙溶液分四次加入,充分反应,四次测量所得数据如表所示:
次数 | 加入氯化钙溶液的质量/g | 烧杯中溶液的总质量/g |
一 | 40 | 134 |
二 | 80 | 168 |
三 | 120 | 202 |
四 | 160 | 242 |
(1)恰好完全反应时,生成沉淀的总质量为_____g。
(2)计算氯化钙溶液的溶质质量分数_____。