ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΈΣ≤βΕ®Ρ≥–Ω―υΤΖΘ®‘”÷ ≤ΜΚ§–Ω‘ΣΥΊΘ§≤Μ»ή”ΎΥ°Θ§“≤≤Μ≤ΈΦ”Ζ¥”ΠΘ©ΒΡ¥ΩΕ»Θ§ Β―ιΙΐ≥ΧΦΑ ΐΨίΦ«¬Φ»γœ¬ΘΚ
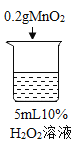
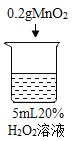
Θ®1Θ© Β―ι÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ ΘΜ
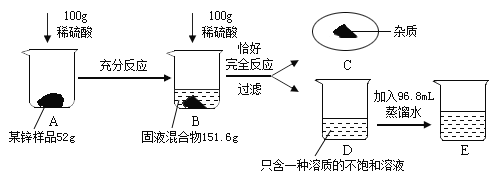
Θ®2Θ©ΗυΨί“―÷ΣΧθΦΰΝ–≥ω«σΫβ AΓζB ≤ΈΦ”Ζ¥”ΠΒΡœΓΝρΥα»ή÷ ÷ ΝΩ(x)ΒΡ±»άΐ ΫΈΣ_____ΘΜ
Θ®3Θ©”Ο 98%ΒΡ≈®ΝρΥα≈δ÷Τ Β―ι÷–Υυ”ΟΒΡœΓΝρΥαΘ§–η“Σ’τΝσΥ°ΒΡΧεΜΐΈΣ_____mLΘΜ
Θ®4Θ©ΗΟ―υΤΖ÷––ΩΒΡ¥ΩΕ»ΈΣ_____ΘΜ
Θ®5Θ©E ΥυΒΟ»ή“Κ÷–»ή÷ ΒΡ÷ ΝΩΖ÷ ΐΈΣ_____ΘΜ
Θ®6Θ©“±ΝΕ 65t …œ ω–Ω―υΤΖΘ§÷Ν…Ό–η“ΣΚ§‘”÷ ΒΡ¬·Η ·Θ®÷ς“Σ≥…Ζ÷ «ΧΦΥα–ΩΘ©ΒΡ÷ ΝΩΈΣ_____ΓΘ
ΓΨ¥πΑΗΓΩΘ®1Θ©![]()
Θ®2Θ©![]()
Θ®3Θ©160
Θ®4Θ©50%
Θ®5Θ©20%
Θ®6Θ©62.5t
ΓΨΫβΈωΓΩ
Θ®1Θ©–Ω”κΝρΥαΖ¥”Π…ζ≥…ΝρΥα–ΩΚΆ«βΤχΘ§Υυ“‘Μ·―ßΖΫ≥Χ ΫΈΣ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΓΘ
ΓΘ
Θ®2Θ©…η≤ΈΦ”Ζ¥”ΠΝρΥα÷ ΝΩΈΣxΘ§Ζ¥”ΠΚσΦθ…ΌΒΡ÷ ΝΩΈΣ…ζ≥…«βΤχ÷ ΝΩ=152g-151.6g=0.4gΘ§
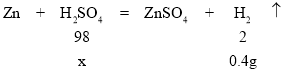
![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΓΘ
ΓΘ
Θ®3Θ©ΗυΨίΧβΡΩ–≈œΔΩ…÷ΣΘ§200gœΓΝρΥα”κ―υΤΖΆξ»ΪΖ¥”ΠΘ§Υυ“‘100gœΓΝρΥαΦ”»κ ±Θ§–ΩΙΐΝΩΘ§œΓΝρΥα»Ϊ≤ΩΖ¥”ΠΘ§ΗυΨίΘ®2Θ©÷–±»άΐ ΫΘ§Ω…“‘«σΒΟx=19.6gΘ§Υυ“‘200gœΓΝρΥα÷–»ή÷ ÷ ΝΩ=19.6gΓΝ2=39.2gΘ§Υυ“‘…η–η“Σ98%≈®ΝρΥα÷ ΝΩΈΣmΘ§
mΓΝ98%=39.2gΘ§m=40gΘ§Φ”»κΥ°ΒΡ÷ ΝΩ=200g-40g=160gΘ§Υυ“‘Φ”»κΥ°ΒΡΧεΜΐ=160gΓ¬1g/mL=160mLΘΜ
Ι ¥πΑΗΈΣΘΚ160ΓΘ
Θ®4Θ©…η100gœΓΝρΥαΖ¥”ΠœϊΚΡΝρΥα÷ ΝΩΈΣyΘ§
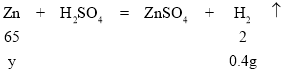
![]()
y=13g
Υυ“‘ΉήΙ≤–ΩΒΡ÷ ΝΩ=2ΓΝ13g=26gΘ§―υΤΖ÷––ΩΒΡ¥ΩΕ»=![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ50%ΓΘ
Θ®5Θ©ΗυΨί÷ ΝΩ ΊΚψΕ®¬…D÷–»ή“Κ÷ ΝΩ”ΠΗΟΈΣΉήΝρΥα÷ ΝΩΦθ»Ξ‘”÷ ÷ ΝΩΘ§‘ΌΦθ»Ξ…ζ≥…ΤχΧεΒΡ÷ ΝΩΘ§100gœΓΝρΥα…ζ≥…0.4g«βΤχΘ§Ρ«200gœΓΝρΥα…ζ≥…0.8g«βΤχΘ§Υυ“‘D÷–»ή“Κ÷ ΝΩ=200g+52g-26g-0.4gΓΝ2=225.2gΘ§Φ”»κ’τΝσΥ°96.8mLΘ§¥Υ ±E÷–»ή“Κ÷ ΝΩ=225.2g+96.8g=322gΘ§…η…ζ≥…ΝρΥα–ΩΒΡ÷ ΝΩΈΣnΘ§
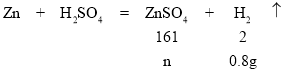
![]()
n=64.4g
Υυ“‘»ή“Κ»ή÷ ÷ ΝΩΖ÷ ΐ=![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ20%ΓΘ
Θ®5Θ©ΗυΨί–Ω‘ΣΥΊ÷ ΝΩ ΊΚψΘ§Ω…÷ΣΧΦΥα–Ω÷––Ω‘ΣΥΊ÷ ΝΩ=―υΤΖ÷––Ω‘ΣΥΊ÷ ΝΩΘ§ΦΌ…η¬·Η ·»Ϊ «ΧΦΥα–ΩΘ§¥Υ ±–η“Σ÷ ΝΩΉν–ΓΘ§Υυ“‘…η–η“ΣΧΦΥα–ΩΒΡ÷ ΝΩΈΣDΘ§
DΓΝ![]() Θ§D=62.5tΘΜ
Θ§D=62.5tΘΜ
¥πΘΚ÷Ν…Ό–η“Σ¬·Η ·ΈΣ62.5tΓΘ
Ι ¥πΑΗΈΣΘΚ62.5tΓΘ

ΓΨΧβΡΩΓΩ“Ώ«ιΤΎΦδ’§≥ωΓΑΟφΒψ»»Γ±Θ§ΖΔΫΆΖέ“Μ ±≥…ΈΣΚήΕύΆχ”―»»“ιΒΡΜΑΧβΘ§ΚήΕύ»Υ‘ΎΦΌΤΎΟ‘…œΝΥΉωΑϋΉ”ΓΔ”ΆΧθΓΔ ÷ΥΚΟφΑϋΒ»Οφ ≥Θ§ΗυΨίΖΔΫΆΖέΘ®Κ§ΧΦΥα«βΡΤΚΆ”–ΜζΥαΒ»Θ©Ω…”κΟφΖέΓΔΥ°ΜλΚœ÷±Ϋ”÷ΤΉςΖΔΟφ ≥ΤΖΒΡ ¬ ΒΘ§ΥΒΟςΧΦΥα«βΡΤΡή”κΥαΖ¥”ΠΓΘΧΦΥα«βΡΤΒΡΥΉ≥ΤΫ–_______ΓΘΖΔΫΆΖέΒΡ÷ς“Σ≥…Ζ÷÷–Κ§”–ΧΦΥα«βΡΤΘ§Ρ≥Μ·―ß–Υ»Λ–ΓΉιΒΡΆ§―ßΕ‘ΧΦΥα«βΡΤΒΡ–‘÷ Ϋχ––ΝΥΧΫΨΩΓΘ
ΔώΘ°Ε®–‘ΧΫΨΩ
“Μ.ΧΫΨΩΧΦΥα«βΡΤΒΡ»»Έ»Ε®–‘
Θ®≤ι‘ΡΉ Νœ]ΧΦΥα«βΡΤ ή»»»ί“ΉΖ÷ΫβΘ§…ζ≥…Υ°ΓΔ“Μ÷÷ΤχΧεΚΆ“Μ÷÷≥ΘΦϊΒΡΙΧΧεΈο÷ ΓΘ
Θ® Β―ι1Θ©»Γ“ΜΕ®÷ ΝΩΒΡΧΦΥα«βΡΤΖ≈ΒΫΆ≠Τ§…œΦ”»»Θ§»γΆΦΥυ ΨΓΘ
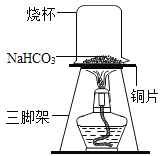
Θ®1Θ©Φ”»»“ΜΕΈ ±ΦδΚσΘ§Ιέ≤λΒΫ…’±≠ΡΎ±Ύ”–Υ°÷ιΓΘ
Θ®2Θ©≥δΖ÷Φ”»»ΚσΘ§ΫΪ…’±≠―ΗΥΌΒΙΉΣΙΐά¥Θ§ΒΙ»κ ΝΩΒΡ≥Έ«ε ·Μ“Υ°Θ§’ώΒ¥Θ§Ιέ≤λΒΫ ·Μ“Υ°±δΜκΉ«Θ§ΥΒΟςΗΟΤχΧε «_______ΓΘ
Θ®3Θ©”ϊΆ®ΙΐΫχ“Μ≤ΫΒΡ Β―ιΧΫΨΩά¥»ΖΕ®≥δΖ÷Φ”»»ΚσΒΡΙΧΧε≤ζΈοΒΡ≥…Ζ÷ΓΘ
ΔΌΩ…Ρή «Na2CO3ΔΎΩ…Ρή «NaOH ΔέΩ…Ρή «_______
Θ® Β―ι2Θ©
Β―ι≤ΌΉς | Β―ιœ÷œσ | Β―ιΫα¬έ |
AΘ°ΫΪΗΟΙΧΧε»ή”Ύ’τΝσΥ°≈δ÷Τ≥…»ή“ΚΘ§»Γ…ΌΝΩ»ή“Κ”Ύ ‘Ιή÷–Θ§ΒΈΦ”ΉψΝΩœΓ―ΈΥα | ”–ΤχΧε≤ζ…ζ | ΦΌ…η_______Θ®Χν–ρΚ≈Θ©≤Μ≥…ΝΔ |
BΘ°Νμ»Γ…ΌΝΩ»ή“Κ”Ύ ‘Ιή÷–Θ§ΒΈΦ”ΉψΝΩΒΡ¬»Μ·±Β»ή“Κ | _______ | ΙΧΧε≤ζΈο÷–”–Na2CO3 |
CΘ°»Γ…œ ωB≤Ϋ÷ηΨ≤÷ΟΚσΥυΒΟ…œ≤ψ«ε“ΚΘ§ΒΈ»κ…ΌΝΩ_______»ή“Κ | ΈόΟςœ‘œ÷œσ | ΦΌ…ηΔΌ≥…ΝΔ |
Θ® Β―ιΫα¬έΘ©NaHCO3 ή»»Ζ÷ΫβΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______ΓΘ
Θ®―”…λΆΊ’ΙΘ© Β―ι “”–ΝΫΤΩ ß»Ξ±ξ«©ΒΡΙΧΧε“©ΤΖΘ§“―÷ΣΥϋΟ« «ΧΦΥαΡΤΚΆΧΦΥα«βΡΤΘ§ΈΣΝΥΦχ±πΧΦΥαΡΤΚΆΧΦΥα«βΡΤΝΫ÷÷ΑΉ…ΪΙΧΧεΘ§…ηΦΤΝΥ≤ΜΆ§ΒΡΖΫΖ®ΉωΝΥ“‘œ¬ Β―ιΘ§»γœ¬ΆΦΥυ ΨΘΚ
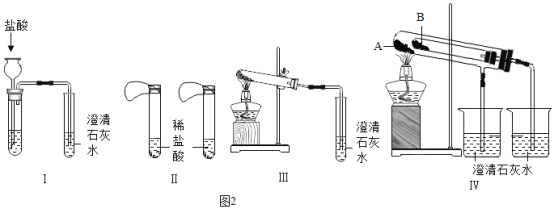
Θ®1Θ©ΆΦIΓΔIIΓΔΔσΓΔIVΥυ Ψ Β―ιΖΫΑΗ÷–Θ§ΡήΙΜ¥οΒΫ Β―ιΡΩΒΡΒΡ «Θ®ΧνΉΑ÷Ο–ρΚ≈Θ©_______ΓΘ
Θ®2Θ© Β―ιIV‘Ύ ‘ΙήB÷–ΉΑ»κΒΡΙΧΧεΉνΚΟ «_______ΓΘ
ΔρΘ°Ε®ΝΩΧΫΨΩ
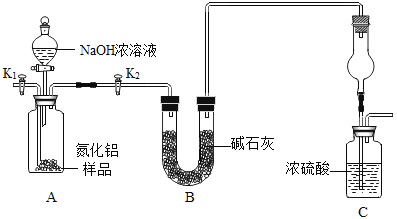
ΈΣ≤βΕ®Ρ≥ΖΔΫΆΖέ÷–ΧΦΥα«βΡΤΒΡ÷ ΝΩΖ÷ ΐΘ®‘”÷ ≤Μ”κΥαΖ¥”ΠΘ©Θ§Α¥»γΆΦΉιΉΑ“«ΤςΘ®ΉΑ÷ΟΤχΟή–‘ΝΦΚΟΘ©Θ§»Γ50g―υΤΖΖ≈»κΉΕ–ΈΤΩ÷–Θ§ΦΤΝΥ»γœ¬ Β―ιΘ§Τδ÷ς“Σ Β―ι≤Ϋ÷η»γœ¬ΘΚ
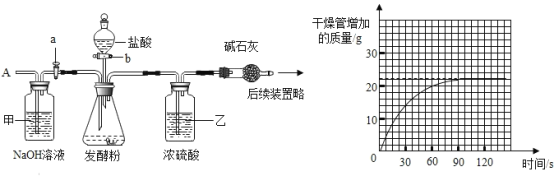
’ΐ»ΖΒΡΥ≥–ρ «________Θ®Χν–ρΚ≈Θ§Ω…÷ΊΗ¥―Γ‘ώΘ©
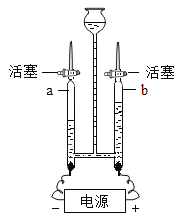
a ≥ΤΝΩΗ…‘οΙήΡΎΦν ·Μ“Θ®―θΜ·ΗΤΚΆ«β―θΜ·ΡΤΙΧΧεΒΡΜλΚœΈοΘ©ΒΡ÷ ΝΩ
b ΙΊ±’»ϊbΘ§¥ρΩΣΜν»ϊaΘ§¥”ΒΦΙήA¥ΠΜΚΜΚΙΡ»κ“ΜΕ®ΝΩΒΡΩ’ΤχΘΜ
c ΙΊ±’Μν»ϊaΘ§¥ρΩΣΜν»ϊbΘ§Φ”»κΉψΝΩœΓ―ΈΥα»ή“ΚΘ§÷±÷ΝΉΕ–ΈΤΩΡΎ≤Μ‘Ό≤ζ…ζΤχ≈ίΘΜ
Θ®1Θ©ΉΑ÷ΟΦΉΒΡΉς”Ο «_______Θ§ΉΑ÷Ο““ΒΡΉς”Ο «_______ΘΜ
Θ®2Θ©«κάϊ”ΟΆΦ÷–œύΙΊ ΐΨίΦΤΥψ―υΤΖ÷–ΧΦΥα«βΡΤΒΡ÷ ΝΩΖ÷ ΐ________Θ®–¥≥ωΦΤΥψΙΐ≥ΧΘ©ΓΘ
ΓΨΧβΡΩΓΩΜ·―ß–Υ»Λ–ΓΉιΕ‘Ρ≥ΤΖ≈Τ―άΗύ÷–ΒΡΡΠ≤ΝΦΝ≥…Ζ÷ΦΑΤδΚ§ΝΩΫχ––“‘œ¬ΧΫΨΩΘΚ
Θ®≤ιΒΟΉ ΝœΘ©
Θ®1Θ©ΗΟ―άΗύΡΠ≤ΝΦΝ”…ΧΦΥαΗΤΓΔ«β―θΜ·¬ΝΉι≥…ΘΜ―άΗύ÷–ΤδΥϋ≥…Ζ÷”ωΒΫ―ΈΥα ±ΈόΤχΧε≤ζ…ζΓΘ
Θ®2Θ©±ΞΚΆΧΦΥα«βΡΤ»ή“Κ≤ΜΈϋ ’Εΰ―θΜ·ΧΦΓΘ
Θ®3Θ©Φν ·Μ“ΒΡ÷ς“Σ≥…Ζ÷ΈΣ―θΜ·ΗΤΚΆ«β―θΜ·ΡΤΓΘ
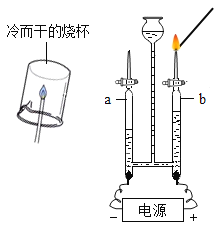
Θ®…ηΦΤ Β―ιΘ©–ΓΉιΆ§―ß…ηΦΤΝΥ»γΆΦΥυ ΨΉΑ÷ΟΘ®ΆΦ÷–Φ–≥÷“«Τς¬‘»ΞΘ©≤βΕ®―άΗύ―υΤΖ÷–ΧΦΥαΗΤΒΡΚ§ΝΩΓΘ
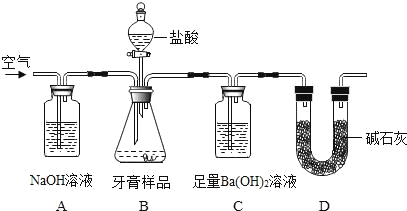
“άΨίΆΦ ΨΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©BΉΑ÷Ο Ι”ΟΖ÷“Κ¬©ΕΖΒΡ”≈Βψ «_____ΓΘ
Θ®2Θ©A÷–«β―θΜ·ΡΤ»ή“ΚΒΡΉς”Ο «_____ΓΘ
Θ®3Θ©C÷–Ιέ≤λΒΫ”–≥ΝΒμ≤ζ…ζΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____ΓΘ
Θ®4Θ© Β―ιΙΐ≥Χ÷––η≥÷–χΜΚΜΚΆ®»κΩ’ΤχΘ§ΤδΉς”Ο”–_____ΓΘ
Θ®Ϋβ Ά”κΫα¬έΘ©ΫΪC÷–≤ζ…ζ≥ΝΒμΆ®Ιΐ_____ΓΔœ¥Β”ΓΔΗ…‘οΓΔ≥ΤΝΩΘ§Ά®ΙΐΦΤΥψ«σΒΟ―άΗύ―υΤΖ÷–ΧΦΥαΗΤΒΡΚ§ΝΩΓΘ
Θ®Ζ¥ΥΦ”κΤάΦέΘ©
Ζ¥ΥΦ Β―ιΙΐ≥ΧΘ§–ΓΗ’Ά§―ßΧα≥ω”Π≤…»Γ±Ί“Σ¥κ ©Θ§ΧαΗΏ≤βΕ®ΉΦ»ΖΕ»ΓΘΥϊΧα≥ωΒΡœ¬Ν–Ηςœν¥κ ©÷–Θ§≤ΜΡήΧαΗΏ≤βΕ®ΉΦ»ΖΕ»ΒΡ «_____Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©ΓΘ
a ‘ΎΦ”»κ―ΈΥα÷°«ΑΘ§≈≈ΨΜΉΑ÷ΟΡΎΒΡCO2ΤχΧε
b Ζ≈¬ΐΒΈΦ”―ΈΥαΒΡΥΌΕ»
c ‘ΎA©¹B÷°Φδ‘ωΧμ Δ”–≈®ΝρΥαΒΡœ¥ΤχΉΑ÷Ο
d ‘ΎB©¹C÷°Φδ‘ωΧμ Δ”–±ΞΚΆΧΦΥα«βΡΤ»ή“ΚΒΡœ¥ΤχΉΑ÷Ο
Θ®ΆΊ’Ι―”…λΘ©–ΓΝΝΆ§―ßΈΣ»ΖΕ®A÷–»ή÷ ≥…Ζ÷Θ§Ϋχ––ΝΥ»γ±μΥυ Ψ Β―ιΘΚ
Β―ι≤ΌΉς | Β―ιœ÷œσ | Β―ιΫα¬έ |
Θ®1Θ©ΓΔ»Γ…ΌΝΩ¬Υ“Κ”Ύ ‘Ιή÷–Θ§Φ”»κΉψΝΩ____ | ≤ζ…ζΑΉ…Ϊ≥ΝΒμ | »ή÷ ÷ς“Σ≥…Ζ÷ΈΣNa2CO3ΚΆNaOH |
Θ®2Θ©ΓΔΙΐ¬ΥΘ§»Γ…ΌΝΩ¬Υ“ΚΦ”»κ | _____ |
ΓΨΧβΡΩΓΩΖ÷άύΓΔάύ±»ΓΔ«®“Τ «―ßœΑΜ·―ßΒΡΖΫΖ®ΓΘ
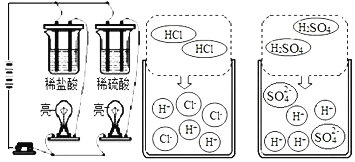
Θ®1Θ©Α¥ Β―ιΡΩΒΡΩ…ΫΪΜ·―ß Β―ιΖ÷ΈΣΘΚΓΑ―–ΨΩΈο÷ ΒΡΉι≥…Γ±ΓΔΓΑ―–ΨΩΈο÷ ΒΡΫαΙΙΓ±ΓΔΓΑ―–ΨΩΈο÷ ΒΡ–‘÷ Γ±ΒΡ Β―ιΒ»ΓΘΨί¥ΥΩ…ΫΪœ¬Ν– Β―ι÷–ΒΡ B ”κ_____ΧνΓΑAΓ±ΜρΓΑCΓ± ΜρΓΑDΓ±Θ©ΙιΈΣ“ΜάύΘ§“άΨί «____ΓΘ
Ω’ΤχΒΡ≥…Ζ÷ | Υ°ΒΡΉι≥… | ±»Ϋœ”≤Ε» | œΓ―ΈΥαΓΔœΓΝρΥαΜ·―ß–‘÷ œύΥΤΒΡ‘≠“ρ |
|
| ΜΞœύΩΧΜ≠ |
|
A | B | C | D |
Θ®2Θ©ΧΦΚΆΧΦΒΡ―θΜ·ΈοΩ…“‘Ϋ®ΙΙΖ¥”ΠΚΆΉΣΜ·ΙΊœΒ»γΆΦΘ§ Βœ÷ΉΣΜ·ΒΡΙΐ≥Χ÷–Θ§Έο÷ ÷–ΧΦ‘ΣΥΊΒΡΜ·ΚœΦέ________ΓΘ
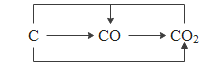
Θ®3Θ©άύ±»…œ ωΖ¥”ΠΚΆΉΣΜ·ΙΊœΒΜΙΩ…Ϋ®ΙΙΚ§ΝρΈο÷ ΦδΒΡΖ¥”ΠΚΆΉΣΜ·ΙΊœΒ»γΆΦΘ§άύ±»Ιΐ≥ΧΜ·―ßΖ¥”Π¥φ‘ΎΒΡΙφ¬…Θ§–¥≥ωbΙΐ≥ΧΘ®ΝρΜ·«βΚΆΕΰ―θΜ·ΝρΉΣΜ·ΈΣ X ΚΆ“Μ÷÷≤ΜΚ§ΝρΒΡΈο÷ Θ©ΒΡΜ·―ßΖΫ≥Χ ΫΔΎ_ΓΘ
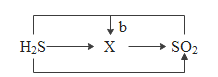
ΓΨΧβΡΩΓΩΈΣΧΫΨΩΙΐ―θΜ·«βΒΡΖ÷ΫβΖ¥”ΠΘ§Ά§―ßΟ«Ϋχ––ΝΥ“‘œ¬ Β―ιΓΘ
Θ®≤ι‘ΡΉ ΝœΘ©Ιΐ―θΜ·«βΖ÷ΫβΖ≈»»ΓΘΒ±―θΤχΒΆ”Ύ“ΜΕ®≈®Ε» ±Θ§Ω…»ΦΈοΈόΖ®»Φ…’ΓΘ
Θ®Ϋχ–– Β―ιΘ©
≥θ≤ΫΧΫΨΩΘΚΧΫΨΩ”ΑœλΙΐ―θΜ·«βΖ÷ΫβΥΌ¬ ΒΡ“ρΥΊ
–ρΚ≈ | …’±≠1 | …’±≠2 | …’±≠3 | …’±≠4 |
Β―ι≤ΌΉς |
|
|
|
|
Β―ιœ÷œσ | ΝΔΦ¥ΟΑ¥σΝΩΤχ≈ίΘ§…’±≠ΡΎ”– …ΌΝΩΑΉΈμ≥ωœ÷ΓΘ | 5Ζ÷÷”ΚσΘ§”–±»Ϋœ¥σΝΩΒΡΤχ≈ίΟΑ≥ωΓΘ | ΝΔΦ¥ΟΑ¥σΝΩΤχ≈ίΘ§…’±≠ΡΎ”–ΑΉΈμΓΘ | ΝΔΦ¥ΟΑ¥σΝΩΤχ≈ίΘ§…’±≠ΡΎ”–¥σΝΩΑΉΈμΓΘ |
ΦΧ–χΧΫΨΩΘΚ÷ΊΗ¥…’±≠1ΓΔ3ΓΔ4 Β―ιΘ§≤ΔΖ÷±π…λ»κ¥χΜπ–«ΡΨΧθΘ§»γœ¬ΆΦΥυ ΨΓΘ
Β―ιΖΫΑΗ | –ρΚ≈ | Β―ιœ÷œσ |
| …’±≠1 | ΡΨΧθΗ¥»ΦΘ§»Φ…’ΚήΆζ |
…’±≠3 | ΡΨΧθΗ¥»ΦΘ§÷°ΚσΜπ―φ±δΈΔ»θ | |
…’±≠4 | ΡΨΧθΗ¥»ΦΘ§÷°ΚσΝΔΦ¥œ®Οπ |
span>
Θ®Ϋα¬έ”κΫβ ΆΘ©
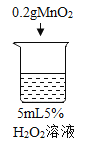
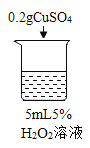
Θ®1Θ©–¥≥ω…’±≠1÷–Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_______ΓΘ
Θ®2Θ©ΈΣ÷ΛΟςMnO2ΚΆCuSO4ΡήΦ”ΩλΙΐ―θΜ·«βΒΡΖ÷ΫβΥΌ¬ Θ§”Π‘ωΦ”ΒΡΕ‘±» Β―ι «_______Θ®ΧνΨΏΧε≤ΌΉςΘ©ΓΘ
Θ®3Θ©Ρή÷ΛΟςΙΐ―θΜ·«β»ή“Κ≈®Ε»”ΑœλΤδΖ÷ΫβΥΌ¬ ΒΡ Β―ι «_____Θ®Χν…’±≠ΒΡ ΐΉ÷–ρΚ≈Θ©ΓΘ
Θ®4Θ©…’±≠ΡΎ≥ωœ÷¥σΝΩΑΉΈμΒΡ‘≠“ρ «_______ΓΘ
Θ®Ζ¥ΥΦ”κΤάΦέΘ©
Θ®5Θ©…’±≠4÷–ΡΨΧθœ®ΟπΒΡ‘≠“ρΩ…Ρή «_______ΓΘ
Θ®6Θ© Β―ι “»τ”ΟΥΪ―θΥ°÷Τ»Γ―θΤχά¥Άξ≥…ΡΨΧΩ»Φ…’ΒΡ Β―ιΘ§”Π―Γ‘ώΒΡ ‘ΦΝ «_______Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©ΓΘ
A5%Ιΐ―θΜ·«β»ή“Κ B10%Ιΐ―θΜ·«β»ή“Κ
C20%Ιΐ―θΜ·«β»ή“Κ DΕΰ―θΜ·ΟΧ