题目内容
【题目】验是进行科学探究的重要方式。同学们设计实验探究二氧化碳的性质,请你参与探究并填空。
(实验记录与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
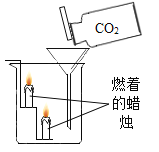
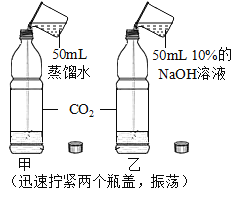
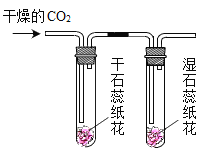
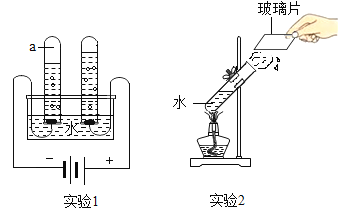
实验现象 | 蜡烛火焰________ | 软塑料瓶变瘪程度较大的是 _____(选填“甲”或“乙”) | 干石蕊纸花不变色,湿石蕊纸花变红色 |
实验结论 | ①二氧化碳的密度比空气大; ②二氧化碳既不能燃烧,也不能支持燃烧 | 二氧化碳能与氢氧化钠发生反应 | ________ |
(反思与拓展)
(1)依据实验一的结论,写出二氧化碳的一条重要用途_____。
(2)由实验二的结论分析得出:实验室中保存氢氧化钠要注意_____。
(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中的方法_____。
【答案】由下向上,依次熄灭 乙 二氧化碳和水反应生成碳酸 灭火 密封保存 控制变量
【解析】
[实验记录与分析]
(1)二氧化碳密度比空气大,不燃烧也不支持燃烧,故蜡烛由下向上依次熄灭,故填:由下向上,依次熄灭。
(2)乙瓶中二氧化碳和氢氧化钠反应生成碳酸钠和水,故乙瓶变瘪程度更大,故填:乙。
(3)干石蕊纸花不变色,湿石蕊纸花刚开始不变色,通入二氧化碳后变红色,说明二氧化碳和水发生反应,生成了碳酸,故填:二氧化碳和水反应生成碳酸。
[反思与拓展]
(1)依据实验一的结论,可得出二氧化碳可用于灭火,故填:灭火。
(2)因为二氧化碳和氢氧化钠能发生反应,所以氢氧化钠需要密封保存,故填:密封保存。
(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中的方法控制变量法,故填:控制变量。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】超市卖的纯碱产品中往往会含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)
实验次数 | 1 | 2 | 3 | 4 |
加人稀盐酸的质量/g | 20 | 20 | 20 | 20 |
烧杯中剩余物质的质量/g | 25.2 | m | 63.8 | 83.8 |
(1)表格中m的值为_____。
(2)样品中Na2CO3的质量分数是多少? (写出计算过程,计算结果精确到0.1%)