题目内容
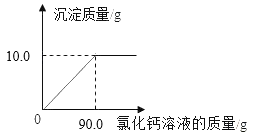
【题目】超市卖的纯碱产品中往往会含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)
实验次数 | 1 | 2 | 3 | 4 |
加人稀盐酸的质量/g | 20 | 20 | 20 | 20 |
烧杯中剩余物质的质量/g | 25.2 | m | 63.8 | 83.8 |
(1)表格中m的值为_____。
(2)样品中Na2CO3的质量分数是多少? (写出计算过程,计算结果精确到0.1%)
【答案】(1)44.4;(2)88.3%
【解析】
(1)据质量守恒定律物质的总质量不变,第一次实验,生成二氧化碳的质量为20g+6g-25.2g=0.8g;第三次实验,产生二氧化碳的质量总质量为6g+60g-63.8g=2.2g,所以第二次实验盐酸也完全反应,生成二氧化碳0.8g,第三次生成二氧化碳0.6g。所以m=20g+20g+6g-1.6g=44.4g;
(2)设样品中Na2CO3的质量为x
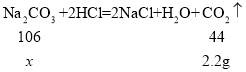
![]()
x=5.3g
样品中Na2CO3的质量分数是:![]() 。
。

 考前必练系列答案
考前必练系列答案【题目】某学校九年级学生小明在化学实验室清点化学药品时发现一包粉末状固体,这包粉末状固体可能由碳酸钠、氯化钠、氢氧化钡、硫酸钠、硝酸铜中的一种或几种组成。为了检验其成分,小明做了如下实验:
(1)取少量粉末状固体于烧杯中,加入足量的水,充分搅拌,静置,发现烧杯底部有白色未溶固体A和上层无色清液B。小明根据上述现象确定粉末状固体中一定不含有的物质是_____(填物质的化学式)。
(2)进一步探究固体A的成分
(提出问题)固体A的成分是什么?
(猜想与假设)I:BaCO3
Ⅱ:_____
III:BaSO4
(实验与探究)
实验步骤 | 实验现象 | 实验结论 | 相关化学方程式 |
取少量固体A于试管中,滴加过量的_____ | _____ | 猜想Ⅱ正确 | _____ |
根据上述实验结论,可以确定粉末状固体中一定含有_____。
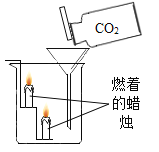
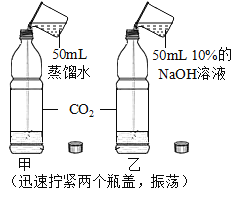
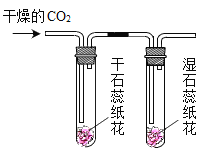
【题目】验是进行科学探究的重要方式。同学们设计实验探究二氧化碳的性质,请你参与探究并填空。
(实验记录与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 蜡烛火焰________ | 软塑料瓶变瘪程度较大的是 _____(选填“甲”或“乙”) | 干石蕊纸花不变色,湿石蕊纸花变红色 |
实验结论 | ①二氧化碳的密度比空气大; ②二氧化碳既不能燃烧,也不能支持燃烧 | 二氧化碳能与氢氧化钠发生反应 | ________ |
(反思与拓展)
(1)依据实验一的结论,写出二氧化碳的一条重要用途_____。
(2)由实验二的结论分析得出:实验室中保存氢氧化钠要注意_____。
(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中的方法_____。