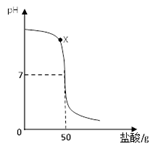
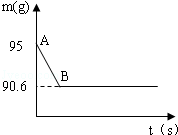
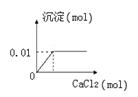
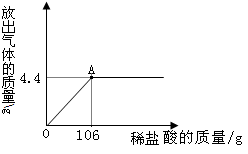
题目内容
(6分)为测定Cu一Zn合金的组成,小华同学利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
| | 第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 1O | 10 | 20 |
| 加入硫酸的质量/g | 50 | 80 | 50 |
| 生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸恰好完全反应;
(2)该合金中锌的质量为多少克?(计算结果保留一位小数)
(3)所用合金中的锌与稀硫酸恰好完全反应时所得溶液中溶质的质量分数为多少?(计算结果精确到0.1%)
(1)1:5 (2)6.5 (3)28.6%
解析试题分析:此题是数据型分析处理题,解答这种题型的关键是把各组数据去分析、去对比,然后找出对解题有帮助的一种数据,根据表中第一次和第二次数据对比,固定合金质量10g,增加硫酸质量,可生成的氢气质量不变,所以可断定当加入50g硫酸时,合金中的锌就反应完全了,再根据表中第一次和第三次数据对比,固定硫酸质量10g,增加合金质量,可生成的氢气质量不变,所以可断定当所取合金质量为10g时,50g溶液中硫酸就反应完全了,这样结合这两组数据的对比,即10g合金中的锌与50g硫酸恰好完全反应,(1)当所取合金与所用稀硫酸的质量比为1:5时,表明合金中的锌与稀硫酸恰好完全反应
(2)根据化学反应-Zn + H2SO4 ="==" ZnSO4 + H2↑中氢气与锌的质量关系,即可求出锌的质量,也可根据氢气与硫酸锌的质量关系,求出完全反应后所得溶液中溶质硫酸锌的质量,再根据溶质的质量分数的表达式,可以算出所得溶液中硫酸锌溶质的质量分数
解:设解:设合金中锌的质量x,为生成硫酸锌的质量为y
Zn + H2SO4 ="===" ZnSO4 + H2↑
65 161 2
x y 0.2 g
(2) 65:2=x:0.2g ∴ x = 6.5 g
161:2=y:0.2g y = 16.1 g
(3)所得溶液中硫酸锌的质量分数: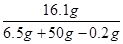 × 100% = 28.6%
× 100% = 28.6%
考点:根据化学方程式进行计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某兴趣小组同学在一次实验中偶然发现:向盛有一定量铁粉的烧杯中加入稀硫酸有气泡产生,迅速加入一定量的氧化铜,搅拌,不再产生气泡、黑色粉末中逐渐出现红色固体后又有气泡产生。请回答:
① 若实验过程中共收集到0.1 g氢气,求生成0.1 g氢气所消耗的硫酸的物质的量。
② 加入氧化铜后,不产生气泡的原因是 (11) (用化学方程式表示)。
③ 充分反应后过滤,为确定滤液中的溶质成分,在滤液样品中插入一根铁丝,可能出现的现象和结论如下。
| 现象 | 结论 |
| (12) | 滤液中的溶质是FeSO4 |
| 有红色固体析出 | 滤液中的溶质可能有哪几种情况? (13) |
| (14) | 滤液中的溶质是 (15) |
一种石灰石样品的成分是CaCO3和SiO2。为了测定该样品中CaCO3的质量分数,现将100g盐酸等分5次加到35g此样品中,得到部分数据与图像。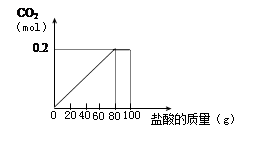
| 次数 | 第1次 | 第3次 | 第4次 |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 30 | a | 15 |
(1)石灰石样品中CaCO3的质量分数是 。
(2)第3次加入盐酸后,a为 g。
(3)反应共产生0.2mol CO2求加入盐酸溶质的质量分数。(根据化学方程式列式计算)