题目内容
某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?
7.35g
解析试题分析:根据溶液中的化学反应的特点:其实就是溶液中的溶质相互反应,所以根据化学方程式:2NaOH + H2SO4 =Na2SO4 + 2H2O中氢氧化钠与H2SO4的质量关系,即可算出H2SO4的质量
解:设一定量石油产品中含H2SO4的质量为x
2NaOH + H2SO4 = Na2SO4 + 2H2O
80 98
40g×15% x
80:98= 40×15%:x
x= 7.35g
考点:根据化学方程式进行计算

练习册系列答案
相关题目
一种石灰石样品的成分是CaCO3和SiO2。为了测定该样品中CaCO3的质量分数,现将100g盐酸等分5次加到35g此样品中,得到部分数据与图像。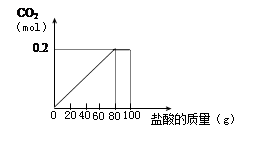
| 次数 | 第1次 | 第3次 | 第4次 |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 30 | a | 15 |
(1)石灰石样品中CaCO3的质量分数是 。
(2)第3次加入盐酸后,a为 g。
(3)反应共产生0.2mol CO2求加入盐酸溶质的质量分数。(根据化学方程式列式计算)
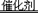 2CO2+N2,当有2.8gCO被转化时,计算同时被转化的NO的质量。
2CO2+N2,当有2.8gCO被转化时,计算同时被转化的NO的质量。