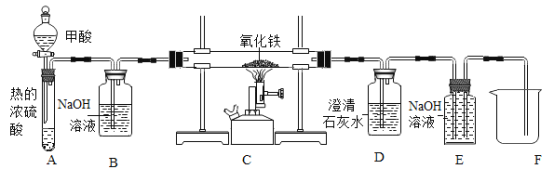
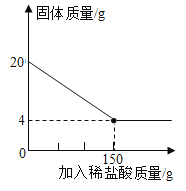
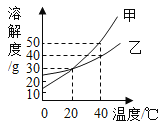
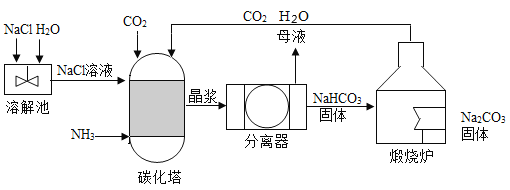
题目内容
【题目】利用废弃白铜(Cu、Ni)分离得到Cu、Ni两种金属,其主要流程如下:
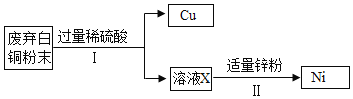
已知:Ni与Fe化学性质相似,常见化合价为+2价。
(1)步骤Ⅰ中反应的化学方程式为_________。
(2)步骤Ⅱ中反应属于基本反应类型中的_______。
【答案】Ni+H2SO4=NiSO4+H2↑ 置换反应
【解析】
(1)步骤Ⅰ中铜是不活泼金属,不与稀硫酸反应,Ni(与Fe化学性质相似)与稀硫酸反应生成NiSO4和氢气,反应的化学方程式为Ni+H2SO4=NiSO4+H2↑。故填:Ni+H2SO4=NiSO4+H2↑。
(2)由(1)分析可知,溶液X中溶质就是硫酸镍,步骤Ⅱ中加入适量锌粒,锌粒将硫酸镍中的镍置换出来,同时生成硫酸锌,该反应符合一种单质与一种化合物反应,生成另一种单质和另一种化合物,这样的反应属于置换反应。故填:置换反应。

练习册系列答案
相关题目
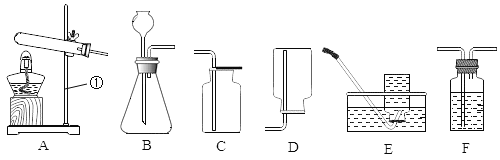
【题目】利用如下图所示步骤进行实验,其中不能达到实验目的的是( )
实验目的 | 实验步骤 | |
A | 比较铁、铜的金属活动性强弱 | ①加入铜粉末;②加入适量稀硫酸搅拌;③加入铁片 |
B | 检验NaCl中混有Na2CO3 | ①加入少量样品;②加入适量水至全部溶解; ③加入适量稀盐酸 |
C | 验证KCl不能无限溶解 | 20°C时,①加入100g水;②加入18gKCl搅拌;③加入16gKCl搅拌(已知:20℃时,KCl的溶解度为34g) |
D | 配置50g溶质质量分数为5%的氯化钠溶液 | ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解 |
A.AB.BC.CD.D