题目内容
【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 40 | m |
第2次 | 40 | 14.8 |
第3次 | 40 | 12.2 |
第4次 | 40 | 11.2 |
第5次 | 40 | 11.2 |
试回答下列问题:
(1)从以上数据可知,最后剩余的11.2g固体的成分是______;表格中,m=______。
(2)黄铜样品中锌的质量分数为______。
(3)计算所用稀硫酸中硫酸的质量分数是多少____?
(4)配制100g该浓度的稀硫酸需要质量分数为98%浓硫酸的质量是多少____?
【答案】Cu 17.4 44% 9.8% 10g
【解析】
(1)由金属活动性可知,合金中只有锌可以与硫酸反应;由表中的数据可知:第4次再加入40g稀硫酸时。第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应;反应掉的锌的质量为:14.8g-12.2g=2.6g,据此分析,m=14.8g+2.6g=17.4g。由第四次反应掉的锌的质量为:12.2g-11.2g=1g<2.6g,可判断此时合金中金属锌已完全反应,剩余的固体11.2g的成分是铜;
(2)黄铜样品中锌的质量分数=![]() ×100%=44%;
×100%=44%;
(3)设40g稀硫酸中硫酸的质量为X,
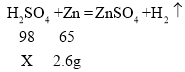
![]() ,
,
X=3.92g,
稀硫酸中硫酸的质量分数=![]() ×100%=9.8%;
×100%=9.8%;
(4)设需要质量分数为98%浓硫酸的质量为Y,则:100g×9.8%=Y×98%,Y=10g。

 名校课堂系列答案
名校课堂系列答案【题目】废铁屑主要成分是铁,还有少量铁锈(Fe2O3),硫酸亚铁的生产工艺如图所示。
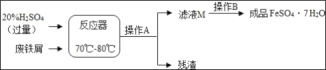
(1)在反应器中除发生Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe═3FeSO4这两个反应外,还会发生另外一个反应,化学方程式为:_____,反应器要加强通风,严禁烟火,其原因是:_____。
(2)将成品在有氧条件下焙烧,可转化为Fe2O3、SO2和SO3.为了提高SO3的产率,某实验小组进行了系列探究,实验数据如下:
编号 | 空气通入量/Ls﹣1 | 温度/℃ | SO2产率% | SO3产率/% |
a | 0.02 | 850 | 45.4 | 54.6 |
b | 0.06 | 850 | 30.5 | 69.5 |
c | 0.10 | 810 | 11.1 | 88.9 |
d | 0.10 | 850 | 11.1 | 88.9 |
e | 0.10 | 890 | 11.2 | 88.8 |
①本实验主要研究了哪些因素对SO3产率的影响_____。
②根据上表数据,生产过程中采用实验_____(填编号)的提取条件最合理。
③分析上表数据,空气的通入量对SO3的产率的影响规律是_____。